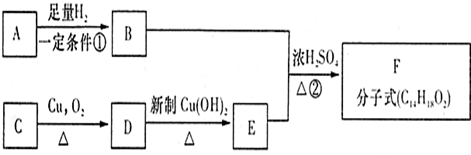
题目内容
将KCl和KBr混合物13.4 00g溶于水配制成500mL溶液,通入过量的Cl2反应后将溶液蒸干,得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A、3:2:1 |
| B、1:2:3 |
| C、2:3:1 |
| D、1:1:1 |
考点:有关混合物反应的计算
专题:计算题
分析:溶液中一定满足电荷守恒,则原溶液中满足:c(Cl-)+c(Br-)=c(K+),同一溶液中则:n(Cl-)+n(Br-)=n(K+),据此对各选项进行判断.
解答:
解:将KCl和KBr混合物溶于水配成的溶液中一定满足:c(Cl-)+c(Br-)=c(K+),
由于在同一溶液中,则:n(Cl-)+n(Br-)=n(K+),
各选项中满足该关系的只有A,
故选A.
由于在同一溶液中,则:n(Cl-)+n(Br-)=n(K+),
各选项中满足该关系的只有A,
故选A.
点评:本题考查了混合物的计算,题目难度不大,明确电荷守恒的含义及在化学计算中的应用方法,本题不需要计算出三者的具体物质的量既可以得出结论,注意巧解法的应用,可以节省节省时间.

练习册系列答案
相关题目
有一种兴奋剂的结构简式如图,下列有关该物质的说法正确的是( )
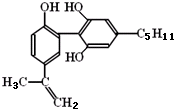

| A、该分子中所有碳原子可以稳定的共存在一个平面中 |
| B、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| C、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| D、滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
下列溶液肯定显酸性的是( )
| A、pH=6的溶液 |
| B、某温度下,c(H+)=c(OH-)=1.0×10-6mol/L的溶液 |
| C、c(H+)>c(OH-) 的溶液 |
| D、常温下,由水电离出的c(H+)=10-13mol/L的溶液 |
下列说法中正确的一组是( )
| A、H2和D2互为同位素; |
B、 和 和  是同一种物质 是同一种物质 |
C、碳链为  与 与  是同分异构体 是同分异构体 |
| D、金刚石、石墨和“足球烯”C60为同系物 |
下列物质不能作为食品添加剂的是( )
| A、甲醇 | B、食盐 |
| C、味精 | D、苯甲酸钠 |
随着卤素(F、Cl、Br、I)原子半径的增大,下列递变规律正确的是( )
| A、单质熔、沸点逐渐降低 |
| B、气态氢化物稳定性逐渐增强 |
| C、卤素离子的还原性逐渐增强 |
| D、单质的氧化性逐渐增强 |