题目内容
随着卤素(F、Cl、Br、I)原子半径的增大,下列递变规律正确的是( )
| A、单质熔、沸点逐渐降低 |
| B、气态氢化物稳定性逐渐增强 |
| C、卤素离子的还原性逐渐增强 |
| D、单质的氧化性逐渐增强 |
考点:卤素原子结构及其性质的比较
专题:卤族元素
分析:A.卤族元素单质的熔沸点与其相对分子质量成正比;
B.非金属的非金属性越强,其气态氢化物的稳定性越强;
C.卤素离子的还原性随着原子序数增大而增强;
D.元素的非金属性越强,其单质的氧化性越强.
B.非金属的非金属性越强,其气态氢化物的稳定性越强;
C.卤素离子的还原性随着原子序数增大而增强;
D.元素的非金属性越强,其单质的氧化性越强.
解答:
解:A.卤族元素单质都是分子晶体,其单质的熔沸点与其相对分子质量成正比,随着原子半径的增大而相对分子质量增大,所以其单质的熔沸点之间升高,故A错误;
B.非金属的非金属性越强,其气态氢化物的稳定性越强,随着卤素(F、Cl、Br、I)原子半径的增大其非金属逐渐减弱,所以其气态氢化物的稳定性逐渐减弱,故B错误;
C.卤素的非金属性越强,其简单阴离子的还原性越弱,卤族元素的非金属性随着原子半径的增大而减弱,则卤素离子的还原性随着原子序数增大而增强,故C正确;
D.元素的非金属性越强,其单质的氧化性越强,卤族元素非金属性随着原子半径的增大而减弱,所以其卤族元素单质的氧化性随着原子半径的增大而减弱,故D错误;
故选C.
B.非金属的非金属性越强,其气态氢化物的稳定性越强,随着卤素(F、Cl、Br、I)原子半径的增大其非金属逐渐减弱,所以其气态氢化物的稳定性逐渐减弱,故B错误;
C.卤素的非金属性越强,其简单阴离子的还原性越弱,卤族元素的非金属性随着原子半径的增大而减弱,则卤素离子的还原性随着原子序数增大而增强,故C正确;
D.元素的非金属性越强,其单质的氧化性越强,卤族元素非金属性随着原子半径的增大而减弱,所以其卤族元素单质的氧化性随着原子半径的增大而减弱,故D错误;
故选C.
点评:本题考查同一主族元素性质递变规律,以碱金属族、卤族为例熟练掌握同一主族性质递变规律,明确其变化规律原因,题目难度不大.

练习册系列答案
相关题目
将KCl和KBr混合物13.4 00g溶于水配制成500mL溶液,通入过量的Cl2反应后将溶液蒸干,得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A、3:2:1 |
| B、1:2:3 |
| C、2:3:1 |
| D、1:1:1 |
盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知7.2g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量.已知单质碳的燃烧热为y kJ?mol-1,则1mol C与O2反应生成CO的反应热△H为( )
| A、-(2.5x-0.5 y) kJ?mol-1 |
| B、-(5x-0.5y) kJ?mol-1 |
| C、-(10x-y)kJ?mol-1 |
| D、-y kJ?mol-1 |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol?L-1的氨水b L
②c(OH-)=1×10-3 mol?L-1的氨水c L
③c(OH-)=1×10-3 mol?L-1的Ba(OH)2溶液d L.
①1×10-3 mol?L-1的氨水b L
②c(OH-)=1×10-3 mol?L-1的氨水c L
③c(OH-)=1×10-3 mol?L-1的Ba(OH)2溶液d L.
| A、c<d=a<b |
| B、c<d<a=b |
| C、c<d<a<b |
| D、c=d<a=b |
不能说明CH3COOH为弱电解质的是( )
| A、能与Na2CO3反应生成CO2 |
| B、同浓度的HCl、CH3COOH稀溶液,CH3COOH的pH大 |
| C、CH3COONa溶液pH>7 |
| D、0.1mol/LCH3COOH溶液pH=1.5 |
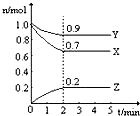 某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )
某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )| A、3X+Y?2Z; 0.05 mol/(L?min) |
| B、2X+Y?2Z; 0.1 mol/(L?min) |
| C、3X+Y?2Z; 0.1 mol/(L?min) |
| D、X+3Y?2Z; 0.05 mol/(L?min) |
溶液中由水电离产生的c(OH-)=1×10-12mol/L,满足此条件的溶液中一定能大量共存的离子组是( )
| A、Fe2+ Na+ NO3- Cl- |
| B、K+Na+ Cl-AlO2- |
| C、K+ Ba2+ Cl- NO3- |
| D、K+ NH4+SO42- CO32- |
下列事实中,不能用勒沙特列原理解释的是( )
| A、开启啤酒后,瓶中马上泛起大量泡沫 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、对2HI(g)?I2(g)+H2(g),平衡体系增大压强可使颜色变深 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
我国报道的高温超导体中,铊是组成成分之一.已知铊和铝是同族元素,关于铊的判断错误的是( )
| A、铊是银白色的金属 |
| B、氢氧化铊是两性氢氧化物 |
| C、能生成+3价的化合物 |
| D、能置换出盐酸中的氢 |