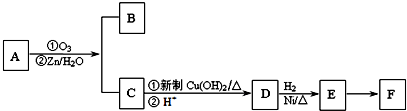
题目内容
下列溶液肯定显酸性的是( )
| A、pH=6的溶液 |
| B、某温度下,c(H+)=c(OH-)=1.0×10-6mol/L的溶液 |
| C、c(H+)>c(OH-) 的溶液 |
| D、常温下,由水电离出的c(H+)=10-13mol/L的溶液 |
考点:探究溶液的酸碱性,水的电离
专题:
分析:A.pH=6的溶液可能呈中性;
B.溶液中c(H+)=c(OH-),则该溶液呈中性;
C.c(H+)>c(OH-) 的溶液呈酸性,c(H+)=c(OH-)的溶液呈中性,c(H+)<c(OH-)的溶液呈碱性;
D.常温下,由水电离出的c(H+)=10-13mol/L的溶液呈酸性或碱性.
B.溶液中c(H+)=c(OH-),则该溶液呈中性;
C.c(H+)>c(OH-) 的溶液呈酸性,c(H+)=c(OH-)的溶液呈中性,c(H+)<c(OH-)的溶液呈碱性;
D.常温下,由水电离出的c(H+)=10-13mol/L的溶液呈酸性或碱性.
解答:
解:A.pH=6的溶液中如果c(H+)=c(OH-),则该溶液呈中性,故A错误;
B.溶液中c(H+)=c(OH-),则该溶液呈中性,故B错误;
C.c(H+)>c(OH-) 的溶液呈酸性,c(H+)=c(OH-)的溶液呈中性,c(H+)<c(OH-)的溶液呈碱性,所以c(H+)>c(OH-) 的溶液一定呈酸性,故C正确;
D.常温下,由水电离出的c(H+)=10-13mol/L>1.0×10-7mol/L,抑制水电离,则该溶液中的溶质可能是酸或碱,故D错误;
故选C.
B.溶液中c(H+)=c(OH-),则该溶液呈中性,故B错误;
C.c(H+)>c(OH-) 的溶液呈酸性,c(H+)=c(OH-)的溶液呈中性,c(H+)<c(OH-)的溶液呈碱性,所以c(H+)>c(OH-) 的溶液一定呈酸性,故C正确;
D.常温下,由水电离出的c(H+)=10-13mol/L>1.0×10-7mol/L,抑制水电离,则该溶液中的溶质可能是酸或碱,故D错误;
故选C.
点评:本题考查探究溶液酸碱性,判断溶液酸碱性要根据溶液中c(H+)、c(OH-)的相对大小判断,不能根据溶液pH判断,为易错题.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
 某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:则该晶体的化学式是( )
某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:则该晶体的化学式是( )| A、AB3C3 |
| B、AB3C |
| C、A2B3C |
| D、A2B2C |
下列物质可用重结晶法提纯的是( )
| A、含杂质的工业酒精 |
| B、含杂质的粗苯甲酸 |
| C、从溴水中提纯溴 |
| D、食盐中混有少量泥沙 |
用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )


| A、22.3mL |
| B、22.30mL |
| C、23.65mL |
| D、23.4 mL |
将KCl和KBr混合物13.4 00g溶于水配制成500mL溶液,通入过量的Cl2反应后将溶液蒸干,得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A、3:2:1 |
| B、1:2:3 |
| C、2:3:1 |
| D、1:1:1 |
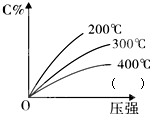 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡右移 |
| C、达平衡后,增加A的量有利于平衡向右移动 |
| D、化学方程式中n>e+f |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol?L-1的氨水b L
②c(OH-)=1×10-3 mol?L-1的氨水c L
③c(OH-)=1×10-3 mol?L-1的Ba(OH)2溶液d L.
①1×10-3 mol?L-1的氨水b L
②c(OH-)=1×10-3 mol?L-1的氨水c L
③c(OH-)=1×10-3 mol?L-1的Ba(OH)2溶液d L.
| A、c<d=a<b |
| B、c<d<a=b |
| C、c<d<a<b |
| D、c=d<a=b |
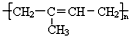 )为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为
)为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为