题目内容
用a、b两个惰性电极电解0.2L一定浓度的硫酸铜溶液,当a极上产生4.48L(标况)气体时,b极上只有固体析出.然后将电源反接,当b极产生4.48L(标况)气体时,溶液质量共减少45.4克.下列说法正确的是( )
| A、将电源反接前a极发生的反应为:2H++2e-=H2↑ |
| B、将电源反接后,a极发生的反应只有Cu2++2 e-=Cu |
| C、整个电解过程只产生一种气体 |
| D、原硫酸铜溶液的浓度为2.5mol/L |
考点:电解原理
专题:
分析:用惰性电极电解电解硫酸铜溶液时的总的电解反应为:2Cu2++2H2O
2Cu+O2↑+4H+,n(O2)=
=0.2mol,所以n(Cu)=2n(O2)=0.4mol,电源反接b为阳极,首先是0.4mol的铜放电,然后是氢氧根离子放电产生氧气0.2mol,而a极首先是溶液中铜离子放电,后来是氢离子放电,根据溶液质量共减少45.4g,综合分析解题.
| ||
| 4.48L |
| 22.4L/mol |
解答:
解:首先a电极产生过4.48L气体,即0.2mol氧气,溶液质量减轻6.4g; 反接之后,b电极析出的铜溶解,A电极析出铜,当b电极铜完全溶解后,a电极的铜析出量与b电极溶解量相同.此阶段溶液质量不变. 当B电极产生气体时,A电极会先析出溶液中剩余的铜,然后产生氢气.b电极产生4.48L气体,即0.2mol氧气,溶液质量减轻6.4g,此时用45.4g减去两次产生氧气的量后,剩余的32.6g是产生铜和析出氢气的总质量.整个过程有1.6mol电子转移,设剩余的铜xmol,产生氢气ymol,根据电子守恒有:2xmol+2ymol=1.6mol,根据质量守恒:64xg+2yg=32.6g,计算出x=0.5,y=0.3,也就是有0.5mol铜析出,根据铜元素守恒,即硫酸铜0.5mol,
A.将电源反接前a极发生的反应为氢氧根失电子生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,故A错误;
B.将电源反接后,a极发生的反应除了Cu2++2 e-=Cu,还有氢离子得电子析出氢气的反应,电极反应式为:2H++2e-=H2↑,故B错误;
C.根据分析可知,既产生了氢气又产生了氧气,故C错误;
D.硫酸铜的浓度为
=2.5mol/L,故D正确,故选D.
A.将电源反接前a极发生的反应为氢氧根失电子生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,故A错误;
B.将电源反接后,a极发生的反应除了Cu2++2 e-=Cu,还有氢离子得电子析出氢气的反应,电极反应式为:2H++2e-=H2↑,故B错误;
C.根据分析可知,既产生了氢气又产生了氧气,故C错误;
D.硫酸铜的浓度为
| 0.5mol |
| 0.2L |
点评:本题考查电解的原理,电源反接后,原来的阳极是变成阴极,阴极变成阳极,然后根据质量差综合分析解题.

练习册系列答案
相关题目
在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g).2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L?min).则下列说法不正确的是( )
| A、z=4 | ||
| B、B的转化率是40% | ||
| C、A的平衡浓度是1.4mol/L | ||
D、平衡时气体压强是原来的
|
 柠檬烯是一种食用香料,其结构简式如图.有关柠檬烯的分析正确的是( )
柠檬烯是一种食用香料,其结构简式如图.有关柠檬烯的分析正确的是( )| A、它的一氯代物有6种 |
| B、它的分子中所有的碳原子一定在同一平面上 |
C、它和丁基苯( )互为同分异构体 )互为同分异构体 |
| D、一定条件下,它分别可以发生加成、氧化等反应 |
下列说法正确的是( )
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A、c (HCN)<c (CN-) |
| B、c (Na+)>c (CN-) |
| C、c (HCN)-c (CN-)=c (OH-) |
| D、c (HCN)+c (CN-)=0.1mol?L-1 |
常温下,有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A、均存在电离平衡与水解平衡 |
| B、c(OH-):①>② |
| C、存在的粒子种类相同 |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
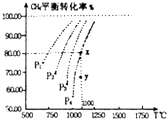 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
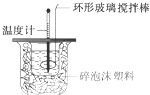 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.