题目内容
在2L容积不变的容器中发生N2+3H2?2NH3的反应,现通入4moIH2和4moIN2,10s后容器中剩下3.2moIN2则该过求N2的转化率是( )
| A、40% | B、20% |
| C、80% | D、15% |
考点:化学平衡的计算
专题:
分析:依据化学平衡三段式列式计算
N2+3H2?2NH3
起始量(mol) 4 4 0
变化量(mol) 0.8 2.4 1.6
10s末量(mol)3.2 1.6 1.6
转化率=
×100%
N2+3H2?2NH3
起始量(mol) 4 4 0
变化量(mol) 0.8 2.4 1.6
10s末量(mol)3.2 1.6 1.6
转化率=
| 消耗量 |
| 起始量 |
解答:
解:依据化学平衡三段式列式计算
N2+3H2?2NH3
起始量(mol) 4 4 0
变化量(mol) 0.8 2.4 1.6
10s末量(mol)3.2 1.6 1.6
N2的转化率=
×100%=
×100%=20%;
故选:20%;
N2+3H2?2NH3
起始量(mol) 4 4 0
变化量(mol) 0.8 2.4 1.6
10s末量(mol)3.2 1.6 1.6
N2的转化率=
| 消耗量 |
| 起始量 |
| 0.8mol |
| 4mol |
故选:20%;
点评:本题考查化学反应速率、转化率的计算,难度较小,注意基础知识的积累理解.

练习册系列答案
相关题目
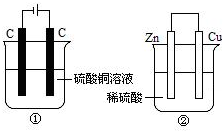 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A、处理废水时加入明矾作为消毒剂可以除去水中的杂质 |
| B、为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 |
| C、金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)?HI(g)+NH3(g),2HI(g)?H2(g)+I2(g),达到平衡后,c(HI)=4mol?L-1,c(I2)=0.5mol?L-1,下列说法中正确的是( )
| A、平衡时,c(NH3)=5mol?L-1 |
| B、若改变反应起始时固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变 |
| C、反应起始时固体NH4I是5mol |
| D、平衡时HI的分解率是10% |
下列有关实验的做法正确的是( )
| A、用pH试纸测氯水的pH |
| B、用托盘天平称取5.72 g NaCl晶体 |
| C、用酸式滴定管量取20.00 mL的酸性KMnO4溶液 |
| D、用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
下列的物质的最浓度关系正确的是( )
| A、NaHCO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、室温下,pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+) |
| C、0.lmol/L CH3COOH溶液与0.1 molNaOH溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) |
| D、CH3COONa溶液与CH3COOH溶液等物质的量混合后溶液呈酸性,所得溶液中:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+) |
 (1)25.C时,0.1mol/L的HA溶液中
(1)25.C时,0.1mol/L的HA溶液中