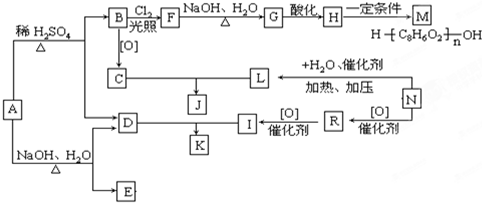
题目内容
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③稀释 ④冷却,转移、洗涤 摇匀 ⑤定容、摇匀 ⑥转入试剂瓶,贴标签.
回答下列问题
(1)所需浓硫酸的体积是 ml,量取浓硫酸所用的量筒的规格是 (从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)第③步实验的操作步骤是
(3)第⑤步实验的操作步骤是
(4)下列情况对所配制的稀硫酸浓度有何影响?(填偏大、偏小、无影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的液凹面
E、用量筒量取浓硫酸时俯视读数 .
回答下列问题
(1)所需浓硫酸的体积是
(2)第③步实验的操作步骤是
(3)第⑤步实验的操作步骤是
(4)下列情况对所配制的稀硫酸浓度有何影响?(填偏大、偏小、无影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的液凹面
E、用量筒量取浓硫酸时俯视读数
考点:硫酸铜晶体中结晶水含量的测定
专题:实验题
分析:(1)根据稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则来选择合适的量筒;
(2)根据浓硫酸稀释时放热来分析稀释的操作;
(3)配制一定物质的量浓度的溶液过程中,定容时先直接加热蒸馏水到离容量瓶刻度线1-2cm处,改用胶头滴管定容;
(4)根据C=
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差;
(2)根据浓硫酸稀释时放热来分析稀释的操作;
(3)配制一定物质的量浓度的溶液过程中,定容时先直接加热蒸馏水到离容量瓶刻度线1-2cm处,改用胶头滴管定容;
(4)根据C=
| n |
| V |
解答:
解:(1)设需要的浓硫酸的体积为Vml,根据稀释定律C浓V浓=C稀V稀可知:18.0mol/L×Vml=100ml×3.0mol/L,解得V=16.7ml;选择量筒时要根据所需的浓硫酸的体积,根据“大而近”的原则来选择合适的量筒,由于浓硫酸需要16.7ml,故选用25ml的量筒最合适,故答案为:16.7,B;
(2)浓硫酸稀释时放热,故稀释时要将浓硫酸沿烧杯内壁注入水中,并用玻璃棒不断搅拌;
故答案为:将浓硫酸沿烧杯内壁注入水中,并用玻璃棒不断搅拌;
(3)配制该稀硫酸时,定容的正确方法为:继续向容量瓶注入蒸馏水至离刻度线1-2cm处时,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;
故答案为:继续向容量瓶注入蒸馏水至离刻度线1-2cm处时,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;
(4)A、所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸吸水,导致浓度变小,则配制出的稀硫酸的浓度偏小,故答案为:偏小;
B、容量瓶用蒸馏洗涤后残留有少量的水,对溶液的体积和溶质的物质的量都无影响,所以浓度无影响,故答案为:无影响;
C、所用过的烧杯、玻璃棒未洗涤,会导致溶质损失,所配溶液浓度偏小,故答案为:偏小;
D、定容时俯视溶液的液凹面,溶液的体积偏小,则浓度偏大,故答案为:偏大;
E、用量筒量取浓硫酸时俯视读数,溶质的物质的量偏小,所配溶液浓度偏小,故答案为:偏小;
(2)浓硫酸稀释时放热,故稀释时要将浓硫酸沿烧杯内壁注入水中,并用玻璃棒不断搅拌;
故答案为:将浓硫酸沿烧杯内壁注入水中,并用玻璃棒不断搅拌;
(3)配制该稀硫酸时,定容的正确方法为:继续向容量瓶注入蒸馏水至离刻度线1-2cm处时,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;
故答案为:继续向容量瓶注入蒸馏水至离刻度线1-2cm处时,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止;
(4)A、所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸吸水,导致浓度变小,则配制出的稀硫酸的浓度偏小,故答案为:偏小;
B、容量瓶用蒸馏洗涤后残留有少量的水,对溶液的体积和溶质的物质的量都无影响,所以浓度无影响,故答案为:无影响;
C、所用过的烧杯、玻璃棒未洗涤,会导致溶质损失,所配溶液浓度偏小,故答案为:偏小;
D、定容时俯视溶液的液凹面,溶液的体积偏小,则浓度偏大,故答案为:偏大;
E、用量筒量取浓硫酸时俯视读数,溶质的物质的量偏小,所配溶液浓度偏小,故答案为:偏小;
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题难易适中,注重灵活性,利于培养学生的逻辑思维能力和严谨的规范实验操作能力,该题的难点在于误差分析,注意掌握误差分析的方法和技巧.

练习册系列答案
相关题目
若在滴定操作中,选用已知浓度的KMnO4溶液测定未知浓度的硫酸亚铁的浓度,高锰酸钾应装入( )
| A、酸式滴定管 |
| B、碱式滴定管 |
| C、酸式、碱式滴定管都可以 |
| D、只能装入锥形瓶,不能装入滴定管中 |
下列说法错误的是( )
| A、Na2SO3溶液与BaCl2溶液混合有白色沉淀生成,加稀HNO3沉淀不消失 |
| B、将SO2气体通入足 量Ba(OH)2溶液中有白色沉淀生成,加足 量HCl后沉淀消失 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成,加稀HCl后沉淀消失 |
| D、将SO2气体通入氯水中无沉淀生成,加入BaCl2溶液有白色沉淀生成 |
两种气态烃以一定比例混合,在105℃时1L该混合气体与9L O2混合,充分燃烧后恢复到原状态,所得气体体积仍为10L,下列各组混合烃中,不符合此条件的是( )
| A、CH4 C2H4 |
| B、CH4 C3H6 |
| C、C2H4 C3H4 |
| D、C2H2 C2H6 |