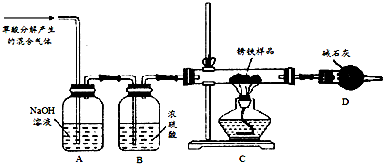
题目内容
4.一定温度下,在一容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:2HI(g)?H2(g)+I2(g)△H>0.下列说法正确的是( )| A. | 若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡 | |
| B. | 容器内的压强不发生变化,表明该反应已达平衡 | |
| C. | 平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大 | |
| D. | 平衡时,若其他条件不变,升高温度,混合气体的颜色加深 |
分析 A.每消耗2n mol HI的同时生成n molH2,表示的都是正反应速率;
B.该反应前后气体总体积不变,则压强始终不变;
C.平衡时,若其他条件不变,再充入一定量HI,相当于增大压强,而压强不影响该平衡;
D.升高温度,平衡向着正向移动,碘单质浓度增大.
解答 解:A.若每消耗2n mol HI的同时生成n mol H2,表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故A错误;
B.反应2HI(g)?H2(g)+I2(g)为气体体积不变的反应,反应过程中氧气始终不变,则不能根据压强判断平衡状态,故B错误;
C.平衡时,若其他条件不变,再充入一定量HI,相当于增大压强,而该反应为气体体积相等的反应,压强不影响平衡,则重新达平衡后,I2的百分含量不变,故C错误;
D.该反应为吸热反应,平衡时若其他条件不变,升高温度,平衡向着正向移动,碘单质的浓度增大,则混合气体的颜色加深,故D正确;
故选D.
点评 本题考查了化学平衡的影响,题目难度不大,侧重考查化学平衡状态的判断,明确化学平衡及其影响因素为解答关键,注意该反应为气体体积不变的反应,压强不影响平衡,为易错点.

练习册系列答案
相关题目
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1 mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2 molN2和0.3 molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
15.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图:
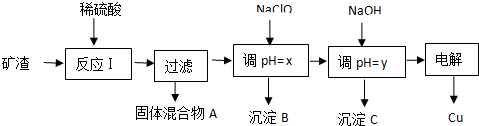
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物A中的成分是SiO2、Cu.
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.
12.下列离子方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| B. | 硫酸和氢氧化铜溶液混合:H++OH-═H2O | |
| C. | 石灰石中加入稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸和氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
9.下列有关化学用语或名称表达正确的是( )
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO32- | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式: | |
| D. |  互为同系物 互为同系物 |
16.元素Y的原子获得3个电子或元素X失去2个电子后,它们的电子层结构与氖原子的相同,X、Y两元素形成的化合物的正确的化学式是( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y2 | D. | Y2X3 |
13.下列各组中的反应,属于同一反应类型的是( )
| A. | 由乙醇与浓H2SO4制备乙烯;则乙烯与水反应制备乙醇 | |
| B. | 由甲苯与液溴制备邻溴甲苯;由苯制备硝基苯 | |
| C. | 由乙醛与O2制备乙酸;由乙醛与H2制备乙醇 | |
| D. | 由油酸甘油酯与H2制备硬脂酸甘油酯;由硬脂酸甘油酯制备硬脂酸 |
14.如图是冰部分结构图,下列有关说法正确的是( )


| A. | 因水分子间存在氢键,所以水加热到很高的温度都难以分解 | |
| B. | 1mol 冰中最多含有 4×6.02×1023个氢键,水分子间的氢键可表示为 O-H…O | |
| C. | 在“H2O(s)→H2O(l)→H2+O2”的变化过程中,被破坏的主要作用依次是氢键、极性键 | |
| D. | 等质量的水和冰,因水结冰后氢键数目变少,所以冰的密度比水小 |