题目内容
0.75mol RO32-共有30mol电子,则R在周期表中的位置是( )
| A、第2周期 | B、第3周期 |
| C、第ⅣA族 | D、第ⅥA族 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:计算出RO32-中含有的电子数,根据阴离子的电子数=质子数+所带的电荷数,再计算出R元素的质子数,根据R元素的质子数确定其在周期表中的位置.电子层数=周期数,最外层电子数=族序数.
解答:
解:由于0.75mol RO32-共有30mol电子,
所以RO32-中含有的电子数目为
=40,
所以R元素原子的质子数为40-2-8×3=14.
所以R元素是Si元素,Si元素原子核外电子排布为2、8、4,位于周期表第三周期第ⅣA族.
故选BC.
所以RO32-中含有的电子数目为
| 30mol |
| 0.75mol |
所以R元素原子的质子数为40-2-8×3=14.
所以R元素是Si元素,Si元素原子核外电子排布为2、8、4,位于周期表第三周期第ⅣA族.
故选BC.
点评:本题考查通过计算推断元素,难度不大,确定R元素的质子数是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
我国南海海底蕴藏着丰富的锰结核--含有锰、铁、铜等金属的矿物.已知锰原子的质子数为25,相对原子质量为55,则锰原子的电子数为( )
| A、25 | B、30 | C、55 | D、80 |
 卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )| A、abcd | B、abc |
| C、bcd | D、ad |
下列化学用语书写正确的是( )
A、氯原子的结构示意图: | ||||||||
B、用电子式表示氯化氢分子的形成过程:H?:
| ||||||||
C、氯化镁的电子式: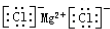 | ||||||||
| D、甲烷的结构式:CH4 |
下列解释正确的是( )
| A、物质的量就是物质的质量 |
| B、物质的量是一个独立的名词 |
| C、阿伏加德罗常数就是6.02×1023 |
| D、NA无单位 |
下述描述中,正确的是( )
| A、已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ.mol-1,N2(g)+O2(g)=2NO(g)△H=+180kJ.mol-1, 则2CO(g)+2NO(g)=N2(g)+2CO2(g);△H=-746kJ/mol | ||
B、由CH3(CH2)2CH3(g)+
| ||
| C、OH(aq)-+H(aq)+=H2O(l)△H=-57.3kJ.mol-1故1mol醋酸与1molOH完全反应,放出的热量一定为57.3kJ | ||
| D、已知P4(白磷,s)=4P(红磷,s)△H<0,则白磷比红磷稳定 |
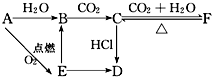 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断: 将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由如图表示.
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由如图表示.