题目内容
 将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由如图表示.
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由如图表示.(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度
④Cl-的浓度 能影响该反应速率的因素有
(3)解释图中AB段形成的原因;
(4)解释图中t1时刻后速率变小的原因
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)根据镁为活泼金属与盐酸反应生成氢气书写离子方程式;
(2)影响反应速率的因素有浓度、温度、催化剂、压强、表面积等,根据反应物的状态判断;
(3)反应属于放热反应,温度升高;
(4)反应物的浓度减小.
(2)影响反应速率的因素有浓度、温度、催化剂、压强、表面积等,根据反应物的状态判断;
(3)反应属于放热反应,温度升高;
(4)反应物的浓度减小.
解答:
解:(1)镁为活泼金属与盐酸反应生成氢气,反应的离子方程式为Mg(s)+2H+═Mg2++H2↑,故答案为:Mg(s)+2H+═Mg2++H2↑;
(2)反应的实质是Mg(s)+2H+═Mg2++H2↑;△H<0,反应速率除与氯离子浓度无关外,其他三个因素对反应速率都有影响,故答案为:①②③;
(3)因反应放热,所以温度逐渐升高,温度升高,反应速率增大,故答案为:反应放热,温度升高,反应速率增大;
(4)随着反应的进行,反应物的浓度逐渐减小,则反应速率减小,故答案为:H+的浓度减小.
(2)反应的实质是Mg(s)+2H+═Mg2++H2↑;△H<0,反应速率除与氯离子浓度无关外,其他三个因素对反应速率都有影响,故答案为:①②③;
(3)因反应放热,所以温度逐渐升高,温度升高,反应速率增大,故答案为:反应放热,温度升高,反应速率增大;
(4)随着反应的进行,反应物的浓度逐渐减小,则反应速率减小,故答案为:H+的浓度减小.
点评:本题考查化学反应速率的影响因素,题目难度不大,注意影响反应速率的因素,以及镁与盐酸反应的特点.

练习册系列答案
相关题目
下列物质中,属于弱电解质的是( )
| A、铁 |
| B、草酸 |
| C、氨水 |
| D、CH3COONa |
如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )


| A、X极是电源负极,Y极是电源正极 |
| B、Cu电极上增重6.4 g时,b极产生2.24 L(标准状况)气体 |
| C、电解过程中CuSO4溶液的pH逐渐增大 |
| D、a极的电极反应式为:2H++2e-═H2↑ |
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )
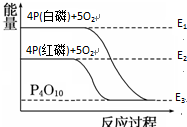

| A、白磷比红磷稳定 |
| B、白磷燃烧是吸热反应 |
| C、红磷转变为白磷是吸热反应 |
| D、红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=(E2-E3)kJ/mol |
下列各组原子中,彼此化学性质最可能相似的是( )
| A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B、原子核外M层上有2个电子的X原子与原子核外N层上有2个电子的Y原子 |
| C、2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 |
| D、L 层上只有一个空p轨道的X原子与M层有一个空p轨道的Y原子 |
0.75mol RO32-共有30mol电子,则R在周期表中的位置是( )
| A、第2周期 | B、第3周期 |
| C、第ⅣA族 | D、第ⅥA族 |