题目内容
10.标准状况下,密度为0.75g•L-1的NH3与CH4组成的混合气体中,该混合气体的平均摩尔质量为16.8g/mol,NH3的体积分数为80%.分析 结合M=ρVm、M=$\frac{m}{n}$计算.
解答 解:标准状况下,密度为0.75g•L-1的NH3与CH4组成的混合气体中,该混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol,设NH3与CH4的物质的量分别为x、y,则$\frac{17x+16y}{x+y}$=16.8,解得x:y=4:1,物质的量比等于体积比,则NH3的体积分数为$\frac{4}{4+1}$×100%=80%,
故答案为:16.8g/mol;80%.
点评 本题考查物质的量的计算,为高频考点,把握平均相对分子质量、质量与物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
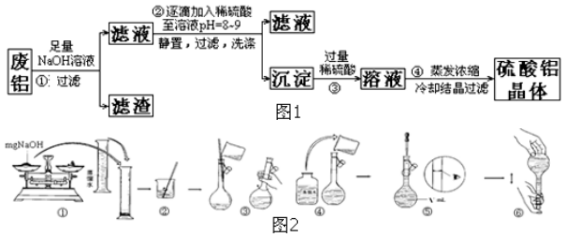
5.下列图示与应叙述相符的是( )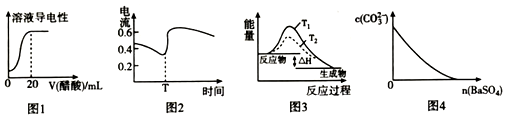

| A. | 图1表示向20mL0.lmol•L-l氯水中逐滴加入0.lmol•L-1醋酸,溶液导电性随加入酸体积的变化 | |
| B. | 图2表示酸性介质Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了 H2O2 | |
| C. | 图3表示S02与O2反应过程中的能量变化,其中T1>T2 | |
| D. | 图4表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c( CO32-)的浓度变化 |
6.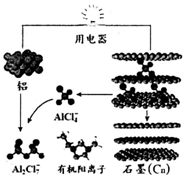 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,电子山石墨电极经用电器流向铝电极 | |
| B. | 充电时,铝电极上发生氧化反应 | |
| C. | 充电时,AlCI4-向铝电极方向移动 | |
| D. | 放电时,负极反应为:Al-3e-+7 AlCl4-═4A12C17- |
3.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 铁粉溶于浓盐酸:Fe+2H+=Fe2++H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| D. | 小苏打溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
2.N2和CH4组成的混合气体,相同条件下其相对于H2的密度为12,则混合气体中N2和CH4的体积比为( )
| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 8:7 |
20.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△S<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气的反应速率和转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示: