题目内容
下列各组物质性质比较中,正确的是( )
| A、氢化物沸点:HI>HBr>HCl>HF |
| B、分子稳定性:HF>H2O>H2S |
| C、离子半径:K+>Cl->S2- |
| D、单质的熔点:Li<Na<K<Rb |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A.HF中含氢键,沸点最大,其它氢化物中相对分子质量越大,沸点越大;
B.非金属性越强,气态氢化物越稳定;
C.具有相同电子排布的离子,原子序数大的离子半径小;
D.碱金属中,原子序数大的原子半径大,金属键弱.
B.非金属性越强,气态氢化物越稳定;
C.具有相同电子排布的离子,原子序数大的离子半径小;
D.碱金属中,原子序数大的原子半径大,金属键弱.
解答:
解:A.HF中含氢键,沸点最大,其它氢化物中相对分子质量越大,沸点越大,则沸点为HF>HI>HBr>HCl,故A错误;
B.非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故B正确;
C.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为K+<Cl-<S2-,故C错误;
D.碱金属中,原子序数大的原子半径大,金属键弱,则单质的熔点为Li>Na>K>Rb,故D错误;
故选B.
B.非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故B正确;
C.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为K+<Cl-<S2-,故C错误;
D.碱金属中,原子序数大的原子半径大,金属键弱,则单质的熔点为Li>Na>K>Rb,故D错误;
故选B.
点评:本题考查元素的性质,为高频考点,把握元素的位置、金属性和非金属性的比较为解答的关键,注意氢键对沸点的影响及离子半径比较的规律,题目难度不大.

练习册系列答案
相关题目
常温时的下列溶液,说法正确的是( )
| A、氨水加水稀释,溶液中各离子浓度均减小 |
| B、Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,Ksp也会发生改变 |
若用乙烯和氯气在适当的条件下反应制取四氯乙烷,乙烯为1mol,反应产物中的有机物只是四氯乙烷,则这一过程中所要经历的反应及耗用氯气的量是( )
| A、取代,4mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成、取代,2mol Cl2 |
| D、加成、取代,3mol Cl2 |
已知R+核外有18个电子.则R元素位于元素周期表的( )
| A、第三周期第ⅤA族 |
| B、第四周期第ⅠA族 |
| C、第五周期第ⅢA族 |
| D、第四周期第ⅤA族 |
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g)此反应达到平衡的标志是( )
| A、正反应和逆反应的速率都为零 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1mol X同时生成0.2mol Z |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A、NH4+、CO32-、K+、Na+ |
| B、Na+、Ba2+、Cl-、HCO3- |
| C、NO3-、Cu2+、K+、SO42- |
| D、NO3-、K+、CO32-、OH- |
最近研制出一种新材料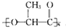 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是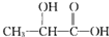 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |