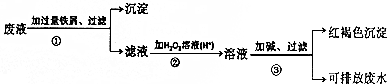
题目内容
17.下列有关浓硫酸的说法不正确的是( )| A. | 具有强腐蚀性 | |
| B. | 能用于氯气、二氧化硫的干燥 | |
| C. | 可贮存在铁制容器中 | |
| D. | 可在盛有浓硫酸的烧杯中加水稀释成稀硫酸 |
分析 A.浓硫酸溶于水放出大量的热,具有腐蚀性;
B.浓硫酸具有吸水性;
C.常温下浓硫酸能够使铁钝化;
D.依据浓硫酸稀释的正确操作解答.
解答 解:A.浓硫酸溶于水放出大量的热,具有腐蚀性,沾到皮肤上能够灼伤皮肤,故A正确;
B.浓硫酸具有吸水性且与氯气、二氧化硫不反应,所以能够干燥二者,故B正确;
C.浓硫酸具有强的氧化性,常温下浓硫酸能够使铁钝化,阻止反应进行,故C正确;
D.浓硫酸稀释时,应将浓硫酸缓缓注入水中,故D错误;
故选:D.
点评 本题考查了元素化合物知识,熟悉浓硫酸的强氧化性、脱水性、吸水性是解题关键,注意浓硫酸的稀释过程,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液充分反应再过滤的方法的是( )
| A. | FeCl2(FeCl3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | NaCl(MgCl2) |
5.用放射性同位素${\;}_{16}^{35}$S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
| A. | 16 | B. | 35 | C. | 19 | D. | 51 |
12.下列离子可以大量共存的是( )
| A. | K+ SO42- Na+ OH- | B. | K+ Ag+ Cl- NO3- | ||
| C. | Ba2+ Na+ CO32- Cl- | D. | Mg2+ NH4+ OH- SO42- |
2.下列离子方程式的书写正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
6.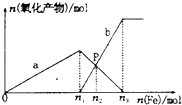 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )| A. | a表示Fe3+的关系曲线,b表示Fe3+的关系曲线 | |
| B. | P点时,n(Fe3+)=0.50 mol | |
| C. | n1=0.75 | |
| D. | n1:n3=2:3 |
7.下列化学用语和描述均正确的是( )
| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为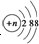 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |
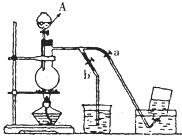 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.