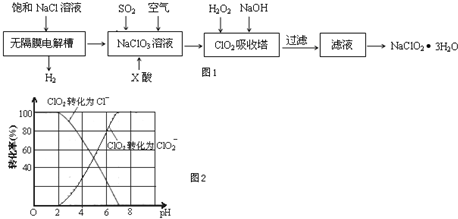
题目内容
元素周期表中,元素Q、R、X、Y原子序数依次减小.且位于不同的连续周期,Q和Y,R和X分别位于同一主族,R的质子数是X的质子数的2倍,回答下列问题:
(1)R元素的最高价氧化物对应水化物的晶体类型为 ,Q、R、X三元素形成的一种正盐水溶液呈碱性的原因是 (用离子方程式表示).
(2)Y分别与R,X形成的分子中,立体结构类型相同的稳定性较弱的物质是(填化学式) ,其原因是 .Y分别与R,X形成的电子总数相同的分子间发生反应的化学方程式为 .
(3)甲、乙分别且全部由上述四种元素组成的离子化合物,将甲、乙两种溶液混合,有气体产物,写出该反应的离子方程式 .
(4)由碳、R、X三种元素组成的气体分子,分子中各原子均达到8电子稳定结构,其对氢气的相对密度为30(相同条件下),则该分子的结构式为 .
(5)将5.1g镁铝合金粉末放入过量R最高价氧化物水化物的稀溶液中,得到5.6L的H2(标准状况下),则该合金中镁和铝的物质的量之比为 .
(1)R元素的最高价氧化物对应水化物的晶体类型为
(2)Y分别与R,X形成的分子中,立体结构类型相同的稳定性较弱的物质是(填化学式)
(3)甲、乙分别且全部由上述四种元素组成的离子化合物,将甲、乙两种溶液混合,有气体产物,写出该反应的离子方程式
(4)由碳、R、X三种元素组成的气体分子,分子中各原子均达到8电子稳定结构,其对氢气的相对密度为30(相同条件下),则该分子的结构式为
(5)将5.1g镁铝合金粉末放入过量R最高价氧化物水化物的稀溶液中,得到5.6L的H2(标准状况下),则该合金中镁和铝的物质的量之比为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:元素周期表中,元素Q、R、X、Y原子序数依次减小.且位于不同的连续周期,Q和Y,R和X分别位于同一主族,R的质子数是X的质子数的2倍,则R是S元素、X是O元素、Y是H元素、Q是K元素;由此解题.
解答:
解:元素周期表中,元素Q、R、X、Y原子序数依次减小.且位于不同的连续周期,Q和Y,R和X分别位于同一主族,R的质子数是X的质子数的2倍,则R是S元素、X是O元素、Y是H元素、Q是K元素;由此解题.
(1)S元素的最高价氧化物对应水化物为H2SO4,是共价化合物,属于分子晶体;Q、R、X三元素形成的一种正盐为K2SO3,水解显碱性SO32-+H2O=HSO3-+OH-,故答案为:分子晶体、SO32-+H2O=HSO3-+OH-;
(2)硫的非金属性比氧弱,故氢化物的稳定性:H2S<H2O;H分别与S,O形成的电子总数相同的分子为H2S和H2O2,它们之间反应生成单质硫和水,方程式为H2S+H2O2=S↓+2H2O;故答案为:H2S、硫的非金属性比氧弱、H2S+H2O2=S↓+2H2O;
(3)全部由上述四种元素组成的离子化合物为KHSO3和KHSO4,它们之间反应生成二氧化硫气体,反应的离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(4)由碳、S、O三种元素组成的气体分子,分子中各原子均达到8电子稳定结构,其对氢气的相对密度为30,该气体的相对分子质量为60,分子式为CSO,结构式为:S=C=O;故答案为:S=C=O;
(5)设镁、铝的物质的量分别为x和y,根据题意知标准状况下的氢气的物质的量为
=0.25mol,
因硫酸过量,金属完全反应,
则有如下关系:
解得x=0.1mol,y=0.1mol,该合金中镁和铝的物质的量之比为1:1;
故答案为:1:1.
(1)S元素的最高价氧化物对应水化物为H2SO4,是共价化合物,属于分子晶体;Q、R、X三元素形成的一种正盐为K2SO3,水解显碱性SO32-+H2O=HSO3-+OH-,故答案为:分子晶体、SO32-+H2O=HSO3-+OH-;
(2)硫的非金属性比氧弱,故氢化物的稳定性:H2S<H2O;H分别与S,O形成的电子总数相同的分子为H2S和H2O2,它们之间反应生成单质硫和水,方程式为H2S+H2O2=S↓+2H2O;故答案为:H2S、硫的非金属性比氧弱、H2S+H2O2=S↓+2H2O;
(3)全部由上述四种元素组成的离子化合物为KHSO3和KHSO4,它们之间反应生成二氧化硫气体,反应的离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(4)由碳、S、O三种元素组成的气体分子,分子中各原子均达到8电子稳定结构,其对氢气的相对密度为30,该气体的相对分子质量为60,分子式为CSO,结构式为:S=C=O;故答案为:S=C=O;
(5)设镁、铝的物质的量分别为x和y,根据题意知标准状况下的氢气的物质的量为
| 5.6L |
| 22.4l/mol |
因硫酸过量,金属完全反应,
则有如下关系:
|
解得x=0.1mol,y=0.1mol,该合金中镁和铝的物质的量之比为1:1;
故答案为:1:1.
点评:本题考查元素推断题,题目难度中等,本题注意电子式的书写以及NH4H的性质,为易错点.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
质量相同的两种气体A、B,A的分子数比B多.在同温、同压下,下列说法不正确的( )
| A、A占的体积比B大 |
| B、A的物质的量比B大 |
| C、A的密度比B小 |
| D、A的摩尔质量比B大 |
一定条件下磷与干燥氯气反应,若12.4g磷消耗掉15.68L氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
| A、1:2 | B、2:3 |
| C、3:1 | D、5:3 |
已知反应:①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,下列说法正确的是( )
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱顺序为KClO3>KBrO3>Cl2>Br2 |
| C、反应②中还原剂与氧化剂的物质的量之比为5:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |