题目内容
17.近几年来关于氮污染的治理备受关注(1)三效催化剂是最常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定
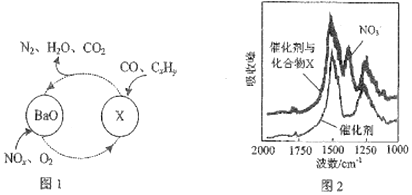
①在图示的转化中,被还原的元索是N、O,X的化学式为Ba(NO3)2.
②氮元素在周期表中的位置是第二周期ⅤA族.
(2)SCR以技术可使NOx与NH3直接反应,实现无害转化.当NO与NO2的物质的量之比为2:l时,写出发生反应的化学方程式:16NH3+12NO+6NO2=17N2+24H2O.已知NOx与NH3的反应△H<O,为提高氮氧化物的转化率可采取的措施是降温.(任写一条).
(3)利用ClO2氧化氮氧化物反应过程如下:NO$→_{反应I}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{NO_{2}SO_{3}水溶液}$N2,反应I的化学方程式是2NO+ClO2+H2O=NO2+HNO3+2HCl,反应II的离子方程式是2NO2+4SO32-=N2+4SO42-.
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl.
①写出次氯酸钠的电子式
 .
.②检验废水中是否存在NH4+的方法是向溶液里滴加浓NaOH溶液并加热,如果有气体放出且能使湿润的红色石蕊试纸变蓝,则溶液里含有NH4+.
③若处理废水产生了0.448L(标准状况),则需消耗浓度为2mol•L-1的次氯酸钠的体积为30 mL.
分析 (1)①根据化合价降低为氧化剂被还原判断;根据傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根;
②根据氮元素原子的核外电子排布情况确定在周期表的位置;
(2)根据NOx与NH3的直接反应,实现无害转化,则生成氮气和水,据此书写方程式;促使化学平衡正向移动的因素就可以提高氮氧化物的转化率;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识来回答判断;
(4)①根据次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl结合得失电子守恒配平方程式,根据反应的离子方程式进行计算;
②检验铵根离子,通常加入强碱溶液加热,然后用湿润的红色石蕊试纸检验,若试纸变蓝,则证明溶液中含有铵根离子,据此进行解答;
③根据反应的离子方程式进行计算.
解答 解:(1)①在图1所示的转化中N、O化合价降低为氧化剂被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根,再结合图一由钡离子参与,所以X为Ba(NO3)2;
故答案为:N、O;Ba(NO3)2;
②氮元素原子的核外电子排布是2、5,所以氮元素在周期表中的位置是:第二周期ⅤA族,故答案为:第二周期ⅤA族;
(2)因为NOx与NH3的直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的量之比为2:1时,发生反应的化学方程式为16NH3+12NO+6NO2=17N2+24H2O,促使化学平衡正向移动的因素就可以提高氮氧化物的转化率,反应△H<O,为提高氮氧化物的转化率可采取的措施是:降温,
故答案为:16NH3+12NO+6NO2=17N2+24H2O;降温;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4SO32-=N2+4SO42-,故答案为:2NO2+4SO32-=N2+4SO42-;
(4)①次氯酸钠为离子化合物,电子式应为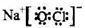 ,故答案为:
,故答案为: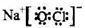 ;
;
②检验铵根离子的方法为:向待测液里加入NaOH溶液,加热,将湿润的红色石蕊试纸放在液面上方,如果溶液变蓝,则待测液中肯定含有NH4+,
故答案为:向溶液里滴加浓NaOH溶液并加热,如果有气体放出且能使湿润的红色石蕊试纸变蓝,则溶液里含有NH4+.
③因为次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,
由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.448L即0.02mol N2(标准状况),则需消耗浓度为2mol•L-1的次氯酸钠的体积为$\frac{0.02×3}{2}$×1000ml=30ml,故答案为:30.
点评 本题重点考查了氧化还原反应以及电解池的原理,从深层次的理解氧化还原反应的本质是解决本题的关键,难度不大,注意化合价降低为氧化剂被还原,化合价升高为还原剂被氧化.

| A. | 由元素X与Z形成的化合物中只含共价键 | |
| B. | XY2、ZY2、M2Y2的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | X的氢化物X2H2分子中含有2个σ键和3个π键 |
 某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADF.
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为10
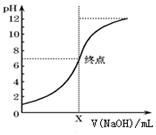
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH=1+lg3,(含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是D
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定--取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
| 数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 23.40 |
| 第二次 | 25.00 | 4.00 | 23.90 |
| 第三次 | 25.00 | 5.00 | 25.10 |
②该草酸溶液的物质的量浓度为0.2 mol/L.
 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式
(写出最后结果)△H=-20.9(T2-T1)KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
Ⅱ.氧化还原滴定实验与中和滴定类似.为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为溶液由无色变为紫色.
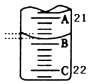
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C=$\frac{60C}{V}$mol/L.
| A. | 2 c1<c2 | B. | c1>c2 | C. | c1=c2 | D. | 2 c1=c2 |
| A. | 氨水 | B. | SO2 | C. | Cl2 | D. | 酒精 |
| A. | 2Q2=Q1=92.4 | B. | Q2<Q1<92.4 | C. | Q1=Q2=92.4 | D. | Q1<Q2<92.4 |
