题目内容
5.一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )| A. | 以X浓度变化表示的反应速率为0.3 mol/(L•min) | |
| B. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ | |
| C. | 若增大X的浓度,则物质Y的转化率减小 | |
| D. | 经12 s达到平衡后,2v(X)=v(Z) |
分析 一定条件下,体积为2L的密闭容器中,1mol X和3mol Y,经12s达到平衡,生成0.6mol Z,则:
X(g)+3Y(g)?2Z(g)
起始量(mol):1 3 0
变化量(mol):0.3 0.9 0.6
平衡量(mol):0.7 2.1 0.6
A.根据v=$\frac{△c}{△t}$计算v(X);
B.12 s后将容器体积扩大为10 L,若平衡不移动,Z的浓度变为原来的$\frac{1}{5}$,但压强减小,平衡正向移动;
C.若增大X的浓度,平衡正向移动,物质Y的转化率增大;
D.正反应速率或逆反应速率之比等于化学计量数之比,到达平衡后不同物质的正、逆速率之比等于其化学计量数之比.
解答 解:一定条件下,体积为2L的密闭容器中,1mol X和3mol Y,经12s达到平衡,生成0.6mol Z,则:
X(g)+3Y(g)?2Z(g)
起始量(mol):1 3 0
变化量(mol):0.3 0.9 0.6
平衡量(mol):0.7 2.1 0.6
A.v(X)=$\frac{\frac{0.3mol}{2L}}{0.2min}$=0.75mol/(L•min),故A错误;
B.12 s后将容器体积扩大为10 L,若平衡不移动,Z的浓度变为原来的$\frac{1}{5}$,但压强减小,平衡正向移动,Z的平衡浓度大于原来的$\frac{1}{5}$,故B错误;
C.若增大X的浓度,平衡正向移动,物质Y的转化率增大,X的转化率减小,故C错误;
D.到达平衡后不同物质的正、逆速率之比等于其化学计量数之比,则2v逆(X)=v正(Z),而2v正(X)=v正(Z),2v逆(X)=v逆(Z),则一定存在2v(X)=v(Z),故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素,D选项为易错点,学生容易按平衡状态判断进行解答.

| A. | 8mol A+4mol B | B. | 2mol A+1mol B | ||
| C. | 6mol C+2mol D+2mol B | D. | 6mol C+2mol D |
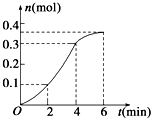
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | n×NA |

 .
. .
.