题目内容
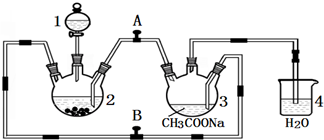
7.写出制备Fe(OH)3胶体的化学方程式:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中逐渐滴加稀盐酸至过量,发生此变化的离子方程式为Fe(OH)3+3H+═Fe3++3H2O.分析 氯化铁水解生成氢氧化铁和氯化氢,向沸水中滴入饱和氯化铁溶液,加热至红褐色得到分散系氢氧化铁胶体;向Fe(OH)3胶体中滴入稀盐酸,先发生胶体的聚沉,然后二者之间会发生复分解反应,氢氧化铁与盐酸发生酸碱中和反应生成氯化铁和水.
解答 解:氯化铁水解生成氢氧化铁和氯化氢,化学方程式:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;氢氧化铁与盐酸发生酸碱中和反应生成氯化铁和水,离子方程式:Fe(OH)3+3H+═Fe3++3H2O;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl; Fe(OH)3+3H+═Fe3++3H2O.
点评 本题考查学生Fe(OH)3胶体的性质、制备等知识,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
相关题目
17.某电化学气敏传感器工作原理如图所示,下列说法正确的是( )
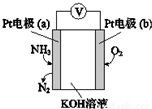

| A. | 该传感器在工作过程中KOH的物质的量不变 | |
| B. | a极的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | b极为负极 |
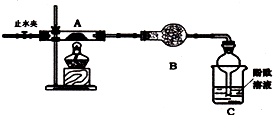
18.下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的纯净、干燥的气体(考虑有毒尾气吸收).关于这些装置的连接,下列说法正确的是( )


| A. | 制备收集CO2:连接b→d→e | B. | 制备收集H2:连接b→c→g | ||
| C. | 制备收集NH3:连接b→d→e→c | D. | 制备收集Cl2:连接a→f→c→e→d |
15.(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合、两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系C.
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB-?H++B2-
回答下列问题:
(5)在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系C.
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB-?H++B2-
回答下列问题:
(5)在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
2.用NA表示你阿伏加德罗常数,下列说法正确的是( )
| A. | 100ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 常温常压下,92g的NO2和N2O4的混合气体中含有的原子个数为6 NA | |
| C. | 用惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生的气体体积一定为11.2L | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为2NA |
16.下列说法正确的是( )
| A. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| B. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |