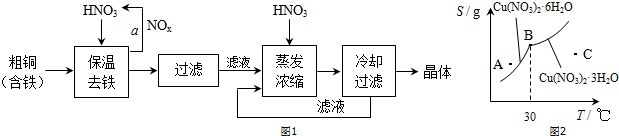
题目内容
2.用NA表示你阿伏加德罗常数,下列说法正确的是( )| A. | 100ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 常温常压下,92g的NO2和N2O4的混合气体中含有的原子个数为6 NA | |
| C. | 用惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生的气体体积一定为11.2L | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为2NA |
分析 A.二氧化锰足量,浓盐酸变成稀盐酸后反应停止;
B.NO2和N2O4的最简式为NO2,根据最简式计算混合物中含有的原子总数;
C.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算;
D.H218O与D2O的摩尔质量都是20g/mol,二者含有10个中子.
解答 解:A.100ml 12mol/L盐酸中含有1.2molHCl,反应消耗1.2molHCl会生成0.3mol氯气,转移0.6mol电子,由于随着反应的进行,浓盐酸变成稀盐酸反应停止,则反应转移的电子小于0.6NA,故A错误
B.常温常压下,92g的NO2和N2O4的混合气体中含有92g最简式NO2,含有最简式NO2的物质的量为$\frac{92g}{46g/mol}$=2mol,则含有6mol原子,含有的原子个数为6NA,故B正确;
C.用惰性电极电解食盐水,由于没有告诉在标准状况下,无法计算生成气体的体积,故C错误;
D.2.0gH218O与D2O的混合物的物质的量为:$\frac{2.0g}{20g/mol}$=0.1mol,0.1mol二者的混合物中含有的中子的物质的量为:0.1mol×10=1mol,所含中子数为NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力

练习册系列答案
相关题目
13.下列叙述正确的是( )
| A. | 标准状况下,22.4L水的物质的量为1mol | |
| B. | 标准状况下,1mol任何气体所占的体积都约为22.4L/mol | |
| C. | 标准状况下,1mol氦气的质量为4g,其所占的体积约为22.4L | |
| D. | 常温常压下,1mol CO2所占的体积不可能等于22.4L |
10.下列有机物的命名正确的是( )
| A. | 二甲苯: | B. | 2,3-甲基-1,3-丁烯: | ||
| C. | 苯甲酸乙酯: | D. | 2,2,3-三甲基戊烷: |
17.下列说法正确的是( )
| A. | 12C、13C、14C、石墨都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
11.下列实验的操作和所用的试剂都正确的是( )
| A. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| B. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 除去溴苯中少量的溴,可以加水后分液 | |
| D. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 |
1.下列物质能使有色布条褪色的是( )
| A. | 干燥的氯气 | B. | 潮湿的氯气 | C. | 干燥的次氯酸钙 | D. | 氯化钙 |
 互为同分异构体且属于芳香烃的有机物的结构简式
互为同分异构体且属于芳香烃的有机物的结构简式 .
. 、
、 .
.