题目内容
18.有4.8g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28g,反应后全部气体用0.6mol•L-1 Ba(OH)2溶液100mL吸收.下列有关叙述中正确的是( )| A. | 原混合物中CuO与Fe2O3物质的量的比为1:2 | |
| B. | 原混合物中CuO与Fe2O3的质量比为2:1 | |
| C. | 吸收CO2后的溶液中一定有Ba(HCO3)2 | |
| D. | 反应中生成的CO2体积为1.792L |
分析 A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,根据n=$\frac{m}{M}$计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;
B、根据m=nM计算CuO、Fe2O3的质量,据此计算判断;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)=$\frac{1.28g}{16g/mol}$=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;
D、状况不知,无法求体积.
解答 解:A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,混合物中氧原子的物质的量为$\frac{1.28g}{16g/mol}$=0.08mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+3y=0.08}\\{80x+160y=4.8}\end{array}\right.$,解得x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的比为0.02mol:0.02mol=l:l,故A错误;
B、原混合物中CuO、Fe2O3的质量之比为80g/mol×0.02mol:160g/mol×0.02mol=1:2,故B错误;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)=$\frac{1.28g}{16g/mol}$=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故C正确;
D、状况不知气体摩尔体积不知,所以无法求体积,故D错误;
故选C.
点评 本题考查混合物的有关计算,难度中等,注意利用守恒思想进行的计算,注意判断二氧化碳与氢氧化钡反应的生成物.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
| A. | X与Z两种元素形成的化合物一定是离子化合物,有且只有离子键 | |
| B. | RX2、WX2、Z2X2都能使品红溶液褪色,且褪色原理相同 | |
| C. | R、W所形成的氧化物的水化物的酸性强弱为W>R | |
| D. | X、Y、R、W四种元素形成的气体氢化物中最稳定的是 Y 的气态氢化物 |
| A. | 糖类都能够发生水解 | |
| B. | 蛋白质的水解产物都含有羧基和羟基 | |
| C. | 油脂碱性水解可以制取肥皂和甘油 | |
| D. | 它们都属于高分子化合物 |
| A. | HA溶液中加入NaA固体后,$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | 常温下,0.1mol/LNaA溶液水解常数为10-9 | |
| D. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)═c(A-)+c(Cl-) |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
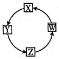 X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是| 选项 | X | Y | Z | W |
| A | Na | Na2O2 | NaOH | NaCl |
| B | H2S | SO2 | SO3 | H2SO4 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
| A. | A | B. | B | C. | C | D. | D |
| 操作 | 现象 |
| 向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应.
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.00mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol•L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液.
①请配平:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
②溶液a中c(H2O2)=0.01mol•L-1.
③溶液褪色速率开始较慢后变快的原因可能是反应生成的Mn2+作催化剂.
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol•L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色.
Ⅳ.向0.1mol•L-1NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化.
①从实验Ⅲ和Ⅳ中,可得出的结论是碱性条件下,H2O2能与酚酞反应而O2不能.
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应.实验方案是:取少量溶液a于试管中,加入MnO2,充分反应后,向上层清液中滴入2滴酚酞后变红,10分钟后,溶液颜色无明显变化.
 如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.
如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.