题目内容
下列说法不正确的是( )
| A、固体NaCl不导电,但 NaCl是电解质 |
| B、CO2的水溶液导电,但 CO2不是电解质 |
| C、铜、石墨均导电,但它们均不是电解质 |
| D、稀硫酸能导电,所以稀硫酸是电解质 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:物质导电的条件是存在自由电子或者自由移动的离子;
在水溶液里或熔融状态下能导电的化合物是电解质;
在水溶液里和熔融状态下都不导电的化合物是非电解质;
单质和混合物既不是电解质也不是非电解质.
在水溶液里或熔融状态下能导电的化合物是电解质;
在水溶液里和熔融状态下都不导电的化合物是非电解质;
单质和混合物既不是电解质也不是非电解质.
解答:
解:A.固体NaCl中不存在自由电子或者自由移动的离子,但是在水溶液里或熔融状态下能导电,是电解质,故A正确;
B.CO2的水溶液导电,是因为与水反应生成的碳酸为电解质,电离产生自由移动的离子,但是二氧化碳本身不能电离,属于非电解质,故B正确;
C.铜、石墨均存在自由电子,所以能导电,但是二者都是单质,所以不是电解质,故C正确;
D.稀硫酸能导电是因为存在自由移动的离子,但是稀硫酸是混合物,所以不是电解质,故D错误;
故选:D.
B.CO2的水溶液导电,是因为与水反应生成的碳酸为电解质,电离产生自由移动的离子,但是二氧化碳本身不能电离,属于非电解质,故B正确;
C.铜、石墨均存在自由电子,所以能导电,但是二者都是单质,所以不是电解质,故C正确;
D.稀硫酸能导电是因为存在自由移动的离子,但是稀硫酸是混合物,所以不是电解质,故D错误;
故选:D.
点评:本题考查了电解质的判断和物质导电的条件,注意电解质必须是化合物,排除单质和混合物.

练习册系列答案
相关题目
下列反应属于氧化还原反应但不属于置换反应的是( )
| A、NaOH+HCl=NaCl+H2O | ||||
B、C+H2O
| ||||
| C、2Na+2H2O=2NaOH+H2↑ | ||||
| D、2Na2O2+2H2O═4NaOH+O2↑ |
下列离子方程式正确的是( )
| A、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
B、苯酚与碳酸钠反应:2C6H5OH+C
| ||
| C、苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O -→C6H5OH+HCO3- | ||
| D、乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O - |
下列说法中,正确的是( )
| A、元素周期表中的第ⅠA族元素全部是碱金属元素 |
| B、元素周期表中的第ⅦA族元素全部是非金属元素 |
| C、元素周期表中的0族元素最外层电子数都是8个 |
| D、元素周期表划分为7个周期18个族 |
下列反应属于吸热反应的是( )
| A、盐酸与氢氧化钠溶液的中和反应 |
| B、氢氧化钡与氯化铵的反应 |
| C、生石灰溶于水 |
| D、金属镁的燃烧 |
下列化学用语表达正确的是( )
| A、甲烷的标准燃烧热△H=-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1 |
B、丙烯的键线式: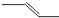 |
| C、一定条件下,某密闭容器中充入2mol SO2(g)和1molO2(g),达到平衡后,放出QkJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ?mol-1 |
| D、乙烯的结构简式:CH2CH2 |
在下面的价层电子构型中,第一电离能最小的原子是( )
| A、2s22p3 |
| B、3s23p5 |
| C、3s23p4 |
| D、3s23p6 |
下列物理变化过程中,化学键被破坏的是( )
| A、碘升华 |
| B、冰融化成水 |
| C、蔗糖溶于水 |
| D、氯化钠晶体在熔化状态下电离 |
下列反应△H<0的是( )
A、、 |
B、 |
C、 |
D、、 |