题目内容
在下面的价层电子构型中,第一电离能最小的原子是( )
| A、2s22p3 |
| B、3s23p5 |
| C、3s23p4 |
| D、3s23p6 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:元素的非金属性越弱,其第一电离能越小,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,据此分析解答.
解答:
解:2s22p3是N元素、3s23p5是Cl元素、3s23p4是S元素、3s23p6是Ar元素,第一电离能大小顺序是Ar>N>Cl>S,所以第一电离能最小的原子是S原子,故选C.
点评:本题考查了元素周期律,明确第一电离能与元素非金属性、同一周期及同一主族元素第一电离能变化规律即可解答,注意规律中的异常现象,题目难度不大.

练习册系列答案
相关题目
下列各组物质全部是弱电解质的是( )
| A、H2SiO3 H2S CO2 |
| B、MgSO4 CH3COOH CH3CH2OH |
| C、H2SO3 BaSO4 CH4 |
| D、H2O NH3?H2O H3PO4 |
 化学概念在逻辑上存在如图所示关系:对下列概念的说法不正确的是
化学概念在逻辑上存在如图所示关系:对下列概念的说法不正确的是( )
| A、纯净物与混合物属于并列关系 |
| B、化合物与氧化物属于包含关系 |
| C、单质与化合物属于交叉关系 |
| D、氧化还原反应与化合反应属于交叉关系 |
下列说法不正确的是( )
| A、固体NaCl不导电,但 NaCl是电解质 |
| B、CO2的水溶液导电,但 CO2不是电解质 |
| C、铜、石墨均导电,但它们均不是电解质 |
| D、稀硫酸能导电,所以稀硫酸是电解质 |
下列表达方式错误的是( )
A、甲烷的电子式 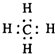 | ||
B、氟化钠的电子式 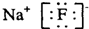 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、碳-12原子
|
某混合溶液中含氯化镁的浓度为2mol/L,含氯化铝的浓度为3mol/L,取此溶液200ml,为了使其中的Mg2+全部转化为Mg(OH)2沉淀分离出来,至少需要加1.6mol/L的氢氧化钠溶液的体积是( )
| A、3.2L |
| B、2 L |
| C、1.8 L |
| D、1.5 L |
下列说法中不正确的是( )
| A、阴阳离子之间通过静电引力形成的化学键叫离子键 |
| B、共价化合物中不可能含有离子键 |
| C、含有共价键的化合物不一定是共价化合物 |
| D、含有离子键的化合物一定是离子化合物 |
下列轨道表示式能表示磷原子的最低能量状态的是( )
A、 |
B、 |
C、 |
D、 |
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.