题目内容
某温度下,将2 molA 和2 molB放入2L密闭容器中,发生反应:A(g)+B(g)?2C(s)=2D(g)△H<0,5min后应达到平衡,测得生成C为0.8mol,下列相关表述正确的是( )
| A、该反应的化学平衡常数为K=0.04 |
| B、若向平衡体系中加入少量生成物A,则A和B的转化率均增大 |
| C、若混合气体的平均摩尔质量不再随时间变化,说明反应达到了平衡状态 |
| D、若给平衡体系升高温度,则正反应速率瞬间减小,逆反应速率瞬间增大 |
考点:化学平衡的影响因素,用化学平衡常数进行计算
专题:
分析:经5min后测得生成C为0.8mol,则消耗的A、B的物质的量各为0.4mol,则
A(g)+B(g)?2C(s)+2D(g)
起始:2mol 2mol 0 0
转化:0.4mol 0.4mol 0.8mol 0.8mol
平衡:1.6mol 1.6mol 0.8mol 0.8mol
以此可解答该题.
A(g)+B(g)?2C(s)+2D(g)
起始:2mol 2mol 0 0
转化:0.4mol 0.4mol 0.8mol 0.8mol
平衡:1.6mol 1.6mol 0.8mol 0.8mol
以此可解答该题.
解答:
解:经5min后测得生成C为0.8mol,则消耗的A、B的物质的量各为0.4mol,则
A(g)+B(g)?2C(s)+2D(g)
起始:2mol 2mol 0 0
转化:0.4mol 0.4mol 0.8mol 0.8mol
平衡:1.6mol 1.6mol 0.8mol 0.8mol
A.反应的化学平衡常数为K=
=0.25,故A错误;
B.向平衡体系中加入少量生成物A,则B的转化率增大,A的转化率减小,故B错误;
C.反应前后气体的体积相等,质量不等,所以混合气体的平均摩尔质量不再随时间变化,能说明反应达到了平衡状态,故C正确;
D.升高温度,则正反应速率瞬间增大,逆反应速率瞬间也增大,故D错误.
故选C.
A(g)+B(g)?2C(s)+2D(g)
起始:2mol 2mol 0 0
转化:0.4mol 0.4mol 0.8mol 0.8mol
平衡:1.6mol 1.6mol 0.8mol 0.8mol
A.反应的化学平衡常数为K=
(
| ||||
|
B.向平衡体系中加入少量生成物A,则B的转化率增大,A的转化率减小,故B错误;
C.反应前后气体的体积相等,质量不等,所以混合气体的平均摩尔质量不再随时间变化,能说明反应达到了平衡状态,故C正确;
D.升高温度,则正反应速率瞬间增大,逆反应速率瞬间也增大,故D错误.
故选C.
点评:本题考查化学平衡的计算,题目难度不大,注意根据三段式法计算较为直观,注意C为固体的特征.

练习册系列答案
相关题目
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、常温下28g乙烯中所含极性键的数目为4NA |
| B、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ |
| C、标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
| D、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
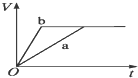
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

| A、加入催化剂,不能改变该化学反应的反应热 |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、该反应的热化学方程式为:N2(g)+3H2(g)???2NH3(g),△H=-92 kJ/mol |
| D、在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
用水稀释0.1mol/L氨水时,溶液中随水量的增加而减小的是( )
| A、c(OH-)/c(NH3?H2O) |
| B、c(NH3?H2O)/c(OH-) |
| C、c(H+)和c(OH-)的乘积 |
| D、n(OH-) |
有机物的结构可用“键线式”简化表示.如:CH3---CH═CH---CH3可以简写为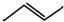 .有机物X的键线式为
.有机物X的键线式为 .下列说法不正确的是( )
.下列说法不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为 .下列说法不正确的是( )
.下列说法不正确的是( )| A、X的化学式为C8H8 |
B、有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式: |
| C、X能使酸性高锰酸钾溶液褪色 |
| D、X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |