题目内容
16.NaNO2大量用于染料工业和有机合成工业中,然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放.处理方法之一(化学反应)如下:2NaNO2+2KI+2H2SO4-2NO+1I2+1K2SO4+1Na2SO4+2H2O
(1)请完成该化学方程式并配平;
(2)在上述反应中,若要生成25.4g I2,则电子转移了0.2NA个;
(3)上述反应中,氧化产物是I2.
分析 (1)分析反应中各元素化合价变化,找出化合价升高和化合价降低的元素,依据氧化还原反应得失电子守恒结合原子个数守恒规律书写方程式;
(2)依据方程式分析碘元素化合价变化数目,依次计算转移电子数;
(3)氧化还原反应中,所含元素化合价升高的反应物为还原剂,对应产物为氧化产物.
解答 解:(1)该反应中:2KI→I2,I元素的化合价由-1价→0价,I失去2e-;NaNO2→NO,N元素的化合价由+3价→+2价,得到e-,要使得失电子守恒,则NaNO2前的系数是2,I2前的系数是1,根据钠、钾原子守恒,K2SO4前是1,Na2SO4前是1,根据硫酸根守恒,反应物少2个H2SO4分子,据氧原子和氢原子守恒,产物水前的系数为2,所以该反应为:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O,
故答案为:2;2;2;2;1;1;1;2H2O;
(2)依据方程式:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O,反应中2KI→I2,生成1mol碘失去2mol电子,50.8g碘单质的物质的量n=$\frac{25.4g}{254g/mol}$=0.1mol,所以转移电子数=nNA=0.1×2NA=0.2NA;
故答案为:0.2NA;
(3)依据方程式:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O可知,2KI→I2,I元素的化合价由-1价→0价,所以KI为还原剂,则对应产物I2 为氧化产物;
故答案为:I2.
点评 本题考查了氧化还原反应方程式配平、电子转移数目计算,明确氧化还原反应规律,准确找出相关物质之间量的关系是解题关键,题目难度中等.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 乙烷和氯气发生二氯取代反应,所得产物只有一种 | |
| B. | 糖类水解的最终产物一定是葡萄糖 | |
| C. | 淀粉和纤维素的组成都可以用(C6H10O5)n表示,所以它们既是同系物又是同分异构体 | |
| D. | 油脂是食物组成中的重要部分,也是产生能量最高的营养物质 |
4.下列实验装置不能达到实验目的是( )

| A. | 比较非金属性强弱:Si弱于C,C弱于S | |
| B. | 用四氯化碳提取碘水中的碘单质 | |
| C. | 观察烧碱的焰色反应 | |
| D. | 比较NaHCO3和Na2CO3的热稳定性 |
11.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH- | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
5. 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
6.今有室温下有四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| B. | ①加入适量的氯化铵晶体后,溶液的pH减小 | |
| C. | ①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-) | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9 |
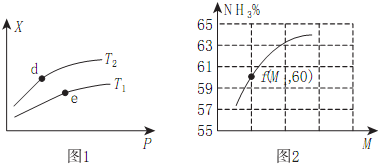 已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497
已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497

 ;
; .
.