题目内容
13.下列说法正确的是( )| A. | 蛋白质、淀粉和油脂都属于高分子化合物 | |
| B. | 人造纤维.合成纤维.碳纤维.光导纤维主要成分都是纤维素 | |
| C. | 误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒 | |
| D. | 福尔马林主要成分是甲酸,由于可使蛋白质变性,可用于保存动物标本 |
分析 A.根据高分子化合物的定义判断;
B.光导纤维主要成分为二氧化硅;
C.重金属盐可使蛋白质变性;
D.福尔马林主要成分是甲醛.
解答 解:A.高分子化合物的相对分子质量在10000以上,油脂不是高分子化合物,故A错误;
B.光导纤维主要成分为二氧化硅,不是纤维素,故B错误;
C.重金属盐可使蛋白质变性,则误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒,故C正确;
D.福尔马林主要成分是甲醛,故D错误.
故选C.
点评 本题综合考查有机物的性质,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3═2NaAlO2+CO2↑
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-..
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
表是相关物质的溶解度数据:
①该反应能发生的理由是温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下四种物质中K2Cr2O7的溶解度最小,利用复分解反应在低温下可以得到重铬酸钾.
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3═2NaAlO2+CO2↑
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-..
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
表是相关物质的溶解度数据:
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
4.某溶液中含有SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是( )
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
1.“陈醋”生产过程中的“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的 品质.假设用含 醋酸质量分 数为3%的半成醋,生产300kg0.945mol•L-1 的优级醋(密度为 1.050g•mL-1 ),产过程中醋酸没有损失,则需捞出的冰和蒸发的水的总质量为( )
| A. | 100kg | B. | 160kg | C. | 240kg | D. | 300kg |
5.某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液).下列说法正确的是( )


| A. | 该原电池的正极反应是Cu2++2e-=Cu | |
| B. | 甲烧杯中溶液的血红色逐渐变浅 | |
| C. | 盐桥中的SO42-流向甲烧杯 | |
| D. | 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 |
2.ClO2是一种国际公认的高效含氯消毒剂.ClO2属于( )
| A. | 混合物 | B. | 酸 | C. | 碱 | D. | 氧化物 |
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: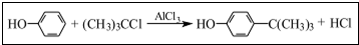 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
