题目内容
(16分)钛合金是航天航空工业的重要原料。由钛铁矿(主要成分是TiO2和Fe的氧化物)
制备Ti和绿矾(FeSO4·7H2O)等产品的一种工艺流程示意如下

已知:①TiO2+易水解,只能存在于强酸性溶液中 ②TiCl4的熔点-25℃,沸点136.4℃;SiCl4的熔点-68.8℃,沸点57.6℃ 回答下列问题:
(1)TiCl4的晶体类型是 晶体。
(2)TiO2的天然晶体中,最稳定的一种晶体结构如图,其中黑球表示 原子。

(3)钛铁矿酸浸时,主要成分TiO2反应的离子方程式为 。
(4)操作Ⅱ包含的具体操作方法有 。
(5)废液中溶质的主要成分是 (填化学式)。
(6)沸腾氧化炉中发生反应的化学方程式为 ,
制得的TiCl4液体中常含有少量SiCl4杂质,可采用 方法除去。
(7)若经事先处理后的钛铁矿只含有TiO2和Fe3O4两种氧化物,现有312kg经处理后的钛铁矿,经上述流程后(省去操作Ⅰ)制得了48kg纯净的金属钛。已知在上述流程的强酸性溶液中加过量铁粉时测得转移的电子的物质的量为2a×103mol,则理论上可制得 kgFeSO4·7H2O(假设上述各步反应均完全且各步没有损耗)。
(16分)(每空2分)(1)分子
(2)Ti或者钛
(3)TiO2+2H+=TiO2++H2O
(4)蒸发浓缩,冷却结晶,过滤(洗涤)
(5)Na2SO4.
(6)TiO2+2C+2Cl2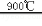 TiCl4+2CO 蒸馏或分馏
TiCl4+2CO 蒸馏或分馏
(7)278( a+3 )
【解析】
试题分析:(1)分子晶体的熔沸点较低,根据TiCl4的熔沸点的数值可以判断,TiCl4属于分子晶体;
(2)根据晶胞结构图,黑球的个数是8×1/8+1=2,白球个数是4×1/2+2=4,黑球:白球=1:2,根据晶体的化学式,Ti与O原子的个数比是1:2,所以黑球表示Ti原子;
(3)根据流程图,TiO2与硫酸反应后,生成TiO2+,所以钛铁矿酸浸时,主要成分TiO2反应的离子方程式为TiO2+2H+=TiO2++H2O;
(4)从滤液中得到晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,所以操作Ⅱ包含的具体操作方法有蒸发浓缩,冷却结晶,过滤(洗涤);
(5)TiSO4溶液中加入碳酸钠固体,发生双水解反应,生成TiO2晶体和二氧化碳气体,所以废液的主要成分是Na2SO4;
(6)根据流程图可知,TiO2与氯气、焦炭,在高温下发生反应生成氯化钛、CO气体,化学方程式为TiO2+2C+2Cl2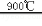 TiCl4+2CO;TiCl4液体中常含有少量SiCl4杂质,二者是互溶的液体,且SiCl4杂质的沸点较低,所以采用蒸馏的方法可除去SiCl4杂质;
TiCl4+2CO;TiCl4液体中常含有少量SiCl4杂质,二者是互溶的液体,且SiCl4杂质的沸点较低,所以采用蒸馏的方法可除去SiCl4杂质;
(7)48kgTi的物质的量是48kg/48g/mol=1kmol,则二氧化钛的质量是312kg-1kmol×80g/mol=232kg,则四氧化三铁的物质的量是232kg/232g/mol=1kmol,Fe元素的物质的量是3kmol;在强酸性溶液中加过量铁粉时测得转移的电子的物质的量为2a×103mol,该过程中Fe单质全部转化为亚铁离子,说明参加反应的Fe物质的量为a×103mol,根据元素守恒,则亚铁离子的物质的量是3kmol+a×103mol=(a+3)kmol,FeSO4·7H2O的质量是278g/mol×(a+3)kmol=278( a+3 )kg。
考点:考查物质的制备,对流程的分析,晶胞计算,基本操作的判断,氧化还原反应的计算

 应用题作业本系列答案
应用题作业本系列答案下述实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 准确称取氯化钾固体,放入到100mL的容量瓶中,加水溶解,振荡摇匀,定容 | 配制100mL一定浓度的氯化钾溶液 |
B | 下层液体从分液漏斗下端口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | 取出分液漏斗中所需的上层液体 |
C | 向盛有沸水的烧杯中滴加FeCl3饱和溶液继续加热至溶液呈红褐色 | 制备Fe(OH)3胶体 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支试管加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |


 属于α-氨基酸);
属于α-氨基酸);
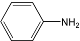 呈弱碱性,易被氧化
呈弱碱性,易被氧化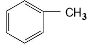 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。 )
) 的数目
的数目