题目内容
(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: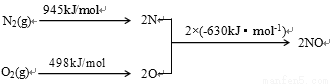
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
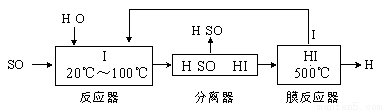
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_____________________。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
(1)4 (3分) (2)①+183 kJ·mol-1 (3分) ②2NO+2CO 2CO2+N2(2分)
2CO2+N2(2分)
(3)①SO2+I2+2H2O=SO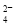 +2I-+4H+(2分)②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行(2分) ③ MH+OH--e-=H2O+M(2分) O2+4e-+2H2O=4OH-(2分)
+2I-+4H+(2分)②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行(2分) ③ MH+OH--e-=H2O+M(2分) O2+4e-+2H2O=4OH-(2分)
【解析】
试题分析:(1)在溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。阴离子所带的负电荷总数是:2c(SO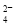 )+c(NO
)+c(NO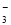 )+c(Cl-)=2×4×10-5+1×3×10-5+1×2×10-5=1.3×10-4mol/L,阳离子所带的正电荷总数是:c(K+)+c(Na+)+c(NH4+)=4×10-6+6×10-6+2×10-5=3×10-5 mol/L<1.3×10-4mol/L,因此溶液显酸性,c(H+)=1.3×10-4mol/L-3×10-5 mol/L=1×10-4mol/L,所以pH=4;(2) ① N2(g)+O2(g)
)+c(Cl-)=2×4×10-5+1×3×10-5+1×2×10-5=1.3×10-4mol/L,阳离子所带的正电荷总数是:c(K+)+c(Na+)+c(NH4+)=4×10-6+6×10-6+2×10-5=3×10-5 mol/L<1.3×10-4mol/L,因此溶液显酸性,c(H+)=1.3×10-4mol/L-3×10-5 mol/L=1×10-4mol/L,所以pH=4;(2) ① N2(g)+O2(g)  2NO(g) △H=+945 kJ/mol+498kJ/mol-2×630 kJ/mol=+183 kJ/mol;②NO被CO还原的化学方程式是2NO+2CO
2NO(g) △H=+945 kJ/mol+498kJ/mol-2×630 kJ/mol=+183 kJ/mol;②NO被CO还原的化学方程式是2NO+2CO 2CO2+N2;(3)①SO2和I2在溶液中发生反应产生硫酸和氢碘酸,用离子方程式表示是SO2+I2+2H2O=SO
2CO2+N2;(3)①SO2和I2在溶液中发生反应产生硫酸和氢碘酸,用离子方程式表示是SO2+I2+2H2O=SO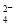 +2I-+4H+;②HI分解为氢气和I2的反应是可逆反应,若及时分离出产物H2,有利于反应正向进行从而可以提高H2的产率;③根据电池的总方程式可知:电池放电时,在负极MH失去电子形成的H+与溶液中的OH-结合形成水,电极反应式为MH+OH--e-=H2O+M;在阴极上氧气得到电子形成OH-;电极反应式为O2+4e-+2H2O=4OH-。
+2I-+4H+;②HI分解为氢气和I2的反应是可逆反应,若及时分离出产物H2,有利于反应正向进行从而可以提高H2的产率;③根据电池的总方程式可知:电池放电时,在负极MH失去电子形成的H+与溶液中的OH-结合形成水,电极反应式为MH+OH--e-=H2O+M;在阴极上氧气得到电子形成OH-;电极反应式为O2+4e-+2H2O=4OH-。
考点:考查溶液中的电荷守恒、热化学方程式的书写、氧化还原反应方程式的书写、影响化学平衡的因素、原电池、电解池的反应原理及应用的知识。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案


 、
、 、
、 表示。已知: 2
表示。已知: 2