题目内容
常温下,下列各组离子在溶液中一定能大量共存的是
A.pH=12的溶液:K+、Na+、CH3COO—、CO23—
B.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl—、SO42—
C.与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3—、NO3—
D.由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32—、Cl—
A
【解析】
试题分析:A、pH=12的溶液呈碱性,离子间互不反应,一定能大量共存,故A正确;B、NO3?、H+能氧化Fe2+,不能大量共存,故B错误;C、与铝反应产生大量氢气的溶液可能为酸性,也可能为碱性,HCO3?与H+、OH?均反应,不能大量共存,故C错误;D、由水电离产生的c(H+)=10-13mol/L的溶液可能为酸性,也可能为碱性,酸性时H+与SO32?反应,碱性时OH?与Ca2+反应,不能大量共存,故D错误。
考点:本题考查离子共存。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: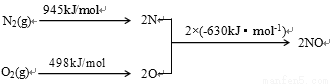
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
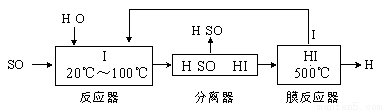
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_____________________。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。



 nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的2.2倍,则 ( )
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的2.2倍,则 ( )


