题目内容
SO42-和 S2O82-(过二硫酸根离子)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.已知S2O82-中两个硫原子间存在过氧键,S2O82-有强氧化性,它能分步水解产生过氧化氢.
(1)画出SO42-的立体结构图,分别用实心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置 .
(2)写出过二硫酸的结构简式 ,确定氧、硫元素的化合价 .
(3)请描述S2O82-有强氧化性的原因 .
(4)写出H2S2O8在D218O中水解的两步反应方程式 、 .
(1)画出SO42-的立体结构图,分别用实心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置
(2)写出过二硫酸的结构简式
(3)请描述S2O82-有强氧化性的原因
(4)写出H2S2O8在D218O中水解的两步反应方程式
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型,根据硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构画图;
(2)S2O82-中存在一个过氧键(-O-O-)、S-O键、S=O键,根据化合价代数和等于所带电荷计算S2O82-中氧、硫元素的化合价;
(3)S2O82-中两个硫原子间存在过氧键,此过氧键中氧元素的化合价为-1价;
(4)过二硫酸可以看成是过氧化氢H-O-O-H中H原子被亚硫酸氢根HSO3-取代所得,所以水解得到过氧化氢;
(2)S2O82-中存在一个过氧键(-O-O-)、S-O键、S=O键,根据化合价代数和等于所带电荷计算S2O82-中氧、硫元素的化合价;
(3)S2O82-中两个硫原子间存在过氧键,此过氧键中氧元素的化合价为-1价;
(4)过二硫酸可以看成是过氧化氢H-O-O-H中H原子被亚硫酸氢根HSO3-取代所得,所以水解得到过氧化氢;
解答:
解:(1)SO42-的价电子对数=
=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构,用实心圆点“●”和空心圆点“○”,所以SO42-的立体结构图为: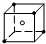 ,
,
故答案为: ;
;
(2)过二硫酸中存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,结构简式为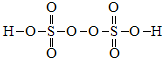 ,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,
,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,
故答案为: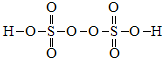 ;氧元素的化合价有-1、-2,硫元素的化合价为+6;
;氧元素的化合价有-1、-2,硫元素的化合价为+6;
(3)S2O82-中过氧键(-O-O-)2个O原子显-1价,可降为稳定价态-2价,具有强氧化性,
故答案为:S2O82-中两个硫原子间存在过氧键,此过氧键中氧元素的化合价为-1价;
(4)过二硫酸可以看成是过氧化氢H-O-O-H中H原子被亚硫酸氢根HSO3-取代所得,所以水解H2S2O8+D218O=HSO318OD+HSO5D;HSO5D+D218O=HSO318OD+D2O2,到过氧化氢,
故答案为:H2S2O8+D218O=HSO318OD+HSO5D;HSO5D+D218O=HSO318OD+D2O2.
| 6+2 |
| 2 |
 ,
,故答案为:
 ;
;(2)过二硫酸中存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,结构简式为
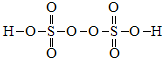 ,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,
,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,故答案为:
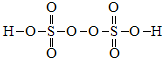 ;氧元素的化合价有-1、-2,硫元素的化合价为+6;
;氧元素的化合价有-1、-2,硫元素的化合价为+6;(3)S2O82-中过氧键(-O-O-)2个O原子显-1价,可降为稳定价态-2价,具有强氧化性,
故答案为:S2O82-中两个硫原子间存在过氧键,此过氧键中氧元素的化合价为-1价;
(4)过二硫酸可以看成是过氧化氢H-O-O-H中H原子被亚硫酸氢根HSO3-取代所得,所以水解H2S2O8+D218O=HSO318OD+HSO5D;HSO5D+D218O=HSO318OD+D2O2,到过氧化氢,
故答案为:H2S2O8+D218O=HSO318OD+HSO5D;HSO5D+D218O=HSO318OD+D2O2.
点评:本题主要考查了关于过二硫酸根离子结构的有关知识,掌握过二硫酸中存在1个过氧键(-O-O-)、4个S=O键,4个S-O键的化学键是解答的关键,题目难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列关于乙醇的说法不正确的是( )
| A、可用纤维素的水解产物制取 |
| B、可由乙烯通过加成反应制取 |
| C、与乙醛互为同分异构体 |
| D、可以用于制取乙酸乙酯 |
下列各项中,理由、结论及因果关系均正确的是( )
| A、由于键能EH-F>EH-Cl,故氢化物的沸点:HF>HCl |
| B、由于分子中可电离的H+个数H2SO4>CH3COOH,故两者的酸性:H2SO4>CH3COOH |
| C、由于元素的非金属性N>P,故最高价氧化物的水化物的酸性:HNO3>H3PO4 |
| D、由于氧化性Fe3+>Cu2+,故还原性Fe2+>Cu |
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B、和C,下列判断中正确的是( )
| A、平衡不移动 |
| B、平衡向正反应方向移动 |
| C、新平衡时各物质的浓度都比原平衡时增大 |
| D、C的质量分数减小 |
 (1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题:
(1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题: