题目内容
5.类推法在学习过程中经常应用.下列左边正确,类推法应用于右边也正确的是( )| A | 向FeCl2溶液中滴入氯水2Fe2++Cl2═2Fe3++2Cl- | 向FeCl2溶液中滴入碘水2Fe2++I2═2Fe3++2I- |
| B | CO2通入漂白粉溶液中CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO | SO2通入漂白粉溶液中SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
| C | 向Na2CO3溶液中滴入稀HNO3CO32-+2H+═CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3SO32-+2H+═SO2↑+H2O |
| D | 向澄清石灰水中通入少量CO2 气体Ca2++2OH-+CO2═CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体Ca2++2OH-+SO2═CaSO3↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.FeCl2溶液与碘水不反应;
B.SO2通入漂白粉溶液,发生氧化还原反应;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应;
D.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水.
解答 解:A.FeCl2溶液与碘水不反应,则前者发生氧化还原反应,后者不反应,与氧化性有关,故A错误;
B.SO2通入漂白粉溶液,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应为2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故C错误;
D.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水,则类推合理,故D正确;
故选D.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
6.在指定的条件下,下列各组离子一定能大量共存的是( )
| A. | 无色的溶液中:Fe3+、K+、NO3-、Cl- | |
| B. | 含有大量Ba2+的溶液中:NH4+、Na+、Cl-、H+ | |
| C. | pH=13的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | c(H+)=0.1 mol•L-1的溶液中:K+、I-、Cl-、NO3- |
16.下列属于吸热反应的是( )
| A. | 锌粒与稀硫酸反应 | B. | 盐酸与氢氧化钠反应 | ||
| C. | 液化石油气的燃烧 | D. | 石灰石高温分解 |
10.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氧化钠是强电解质,醋酸是弱电解质 | |
| C. | 氨气是弱电解质,铜是强电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
17.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:
①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.
由此可得出关于原溶液组成的正确结论是( )
①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.
由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg2+、Al3+、Clˉ,可能含有Na+,不含NH4+ | |
| B. | 一定含有Mg2+、Clˉ,不含NH4+,可能含有Na+、Al3+ | |
| C. | c (Clˉ) 为 4.00 mol•L-1,c(Al3+)为5.00 mol•L-1 | |
| D. | c (Mg2+) 为 1.00 mol•L-1,c(Na+)为 0.5mol•L-1 |
14.一种微生物燃料电池的结构示意图如图所示,关于该电池的叙述不正确的是( )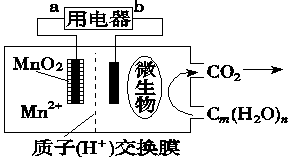

| A. | 电池工作时,电子由b流向a | |
| B. | 正极反应式为:MnO2+4H++2e-═Mn2++2H2O | |
| C. | 放电过程中,H+从负极区移向正极区 | |
| D. | 微生物所在电极区放电时发生还原反应 |
15.不能使橙色溴水层变为无色的是( )
| A. | NaOH溶液 | B. | 用CCl4多次萃取 | C. | 锌粉 | D. | KI 溶液 |
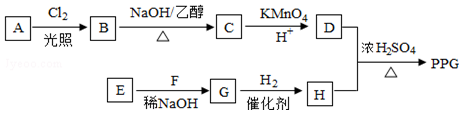
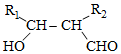
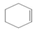 在酸性高锰酸钾溶液中反应生成HOOCCH2CH2CH2CH2COOH
在酸性高锰酸钾溶液中反应生成HOOCCH2CH2CH2CH2COOH .
. .
.
 :
: