题目内容
设NA为阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、标准状况下,22.4L氯气与足量的NaOH溶液反应,转移的电子数目为2NA |
| B、1L 0.5mol/L FeCl3溶液中Fe3+数目为0.5NA |
| C、常温常压下,8.8g丙烷中所含电子数为5.2NA |
| D、78g过氧化钠中所含阴离子数目为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、体积换算成物质的量,结合氧化还原反应的实质分析计算;
B、Fe3+是弱碱阳离子,在溶液中会水解;
C、根据丙烷的物质的量和1mol丙烷中含26mol电子来分析;
D、根据过氧化钠中的阴离子是过氧根离子计算.
B、Fe3+是弱碱阳离子,在溶液中会水解;
C、根据丙烷的物质的量和1mol丙烷中含26mol电子来分析;
D、根据过氧化钠中的阴离子是过氧根离子计算.
解答:
解:A、22.4L(标准状况)Cl2的物质的量为n=
=1mol,氯气物质的量为1mol,与碱反应Cl2+2NaOH═NaCl+NaClO+H2O,是氯气自身的氧化还原反应,电子转移为1mol,故A错误;
B、Fe3+是弱碱阳离子,在溶液中会水解,会导致三价铁离子数目小于0.5NA,故B错误;
C、丙烷的物质的量n=
=
=0.2mol,而1mol丙烷中含26mol电子,故0.2mol丙烷中含5.2mol电子,故C正确;
D、78g过氧化钠的物质的量为1mol,含有1mol阴离子过氧根离子,所含阴离子数为NA,故D错误;
故选C.
| 22.4L |
| 22.4L/mol |
B、Fe3+是弱碱阳离子,在溶液中会水解,会导致三价铁离子数目小于0.5NA,故B错误;
C、丙烷的物质的量n=
| m |
| M |
| 8.8g |
| 44g/mol |
D、78g过氧化钠的物质的量为1mol,含有1mol阴离子过氧根离子,所含阴离子数为NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列化学用语书写正确的是( )
A、甲烷的电子式: |
| B、乙醛的结构简式:CH3COH |
| C、乙烯的结构式:CH2=CH2 |
D、乙醇的结构式: |
下列说法或表示方法正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-285.8 kJ?mol-1 |
| C、吸热反应都需加热才能完成 |
| D、热化学方程式的化学计量数只表示物质的量,不表示物质的分子数或原子数 |
下列离子方程式中,属于水解反应的是( )
| A、HCOOH+H2O?HCOO-+H3O+ |
| B、CO32-+H2O?HCO3-+OH- |
| C、CO2+H2O?HCO3-+H+ |
| D、HS-+H2O?S2-+H3O+ |
胶体区别于其他分散系的本质特征是( )
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、产生丁达尔现象 |
| C、分散质粒子直径在1nm~100nm之问 |
| D、胶体在一定条件下能聚沉 |
下面的反应路线中相关说法正确的是
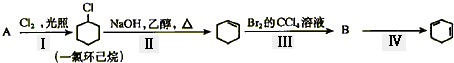 ( )
( )
 ( )
( )| A、物质A的分子式为C6H6 |
| B、线路中的一氯环己烷为氯代芳香烃 |
C、产物 能使酸性高锰酸钾溶液褪色 能使酸性高锰酸钾溶液褪色 |
| D、步骤Ⅳ的反应类型为水解反应 |
