题目内容
下列离子方程式中,属于水解反应的是( )
| A、HCOOH+H2O?HCOO-+H3O+ |
| B、CO32-+H2O?HCO3-+OH- |
| C、CO2+H2O?HCO3-+H+ |
| D、HS-+H2O?S2-+H3O+ |
考点:离子方程式的书写,盐类水解的原理
专题:
分析:水解反应中有水参加反应,为弱酸离子或弱碱离子与水电离的氢离子或氢氧根离子结合生成弱电解质的反应,据此对各选项进行判断.
解答:
解:A.HCOOH+H2O?HCOO-+H3O+为弱电解质甲酸的电离方程式,故A错误;
B.CO32-+H2O?HCO3-+OH-为碳酸根离子的水解反应的离子方程式,故B正确;
C.CO2+H2O?HCO3-+H+不是碳酸的电离方程式,也不是水解离子反应,故C错误;
D.HS-+H2O?S2-+H3O+为硫氢根离子的电离方程式,故D错误;
故选B.
B.CO32-+H2O?HCO3-+OH-为碳酸根离子的水解反应的离子方程式,故B正确;
C.CO2+H2O?HCO3-+H+不是碳酸的电离方程式,也不是水解离子反应,故C错误;
D.HS-+H2O?S2-+H3O+为硫氢根离子的电离方程式,故D错误;
故选B.
点评:本题考查离子反应,侧重水解的离子反应的考查,题目难度不大,明确水解的离子反应、电离的离子反应、化学反应中的离子反应即可解答,注重反应类型的分析.

练习册系列答案
相关题目
用水稀释0.1mol/L醋酸时,溶液中随着水量的增加而减小的是( )
A、
| ||
B、
| ||
C、
| ||
| D、c(OH-) |
下列说法中不正确的是( )
| A、蓄电池在放电过程中,负极质量增加,正极质量也增加 |
| B、电解法是最强有力的氧化还原手段,可以将极难还原的活泼金属从它们的化合物中还原出来 |
| C、钢铁发生吸氧腐蚀时,负极反应式为:Fe-3e-═Fe3+ |
| D、电解精炼铜时,用纯铜板作阴极,粗作阳极,用硫酸铜溶液作电解液铜板 |
下列混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
| A、甲烷、乙烯 |
| B、丙醛、丙醇 |
| C、甲醛、甲酸甲酯 |
| D、苯、甲苯 |
设NA为阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、标准状况下,22.4L氯气与足量的NaOH溶液反应,转移的电子数目为2NA |
| B、1L 0.5mol/L FeCl3溶液中Fe3+数目为0.5NA |
| C、常温常压下,8.8g丙烷中所含电子数为5.2NA |
| D、78g过氧化钠中所含阴离子数目为2NA |
下列离子方程式中,正确的是( )
| A、碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
| C、铜粉加入FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ |
| D、醋酸跟碳酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O |
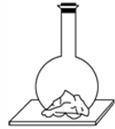 向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )
向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )| A、该反应是一个熵减的反应 |
| B、该反应△H>0,△H-T△S<0 |
| C、吸热反应在常温下一定不能进行 |
| D、能自发进行的反应一定能迅速发生反应 |

