题目内容
以废铁屑为原料生产莫尔盐的主要流程如下:
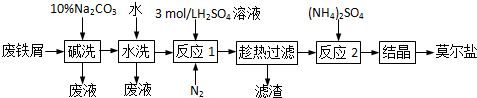
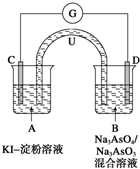
(1)“反应I”中通入N2的作用是 .
(2)为确定莫尔盐的化学式,设计以下实验:称取23.52g新制莫尔盐,溶于水配制成100mL溶液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol?L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00mL.
①在上述实验过程中,确定Ba(OH)2溶液已经足量的方法是 .
若要使溶液中能被Ba(OH)2沉淀的离子的残余浓度不高于1.0×10-5mol/L,则Ba(OH)2在溶液中的残余浓度应不低于 mol/L(已知:Ksp(BaSO4)=1.1×10-10,Ksp[Fe(OH)2]=4.9×10-17,
≈2.2).
②通过计算确定莫尔盐的化学式 .(写出计算过程)

(1)“反应I”中通入N2的作用是
(2)为确定莫尔盐的化学式,设计以下实验:称取23.52g新制莫尔盐,溶于水配制成100mL溶液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol?L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00mL.
①在上述实验过程中,确定Ba(OH)2溶液已经足量的方法是
若要使溶液中能被Ba(OH)2沉淀的离子的残余浓度不高于1.0×10-5mol/L,则Ba(OH)2在溶液中的残余浓度应不低于
| 4.9 |
②通过计算确定莫尔盐的化学式
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量,制备实验方案的设计
专题:实验设计题
分析:废铁屑碱洗除去油污,水洗除去表面碱液,加入硫酸和表面氧化铁反应生成硫酸铁和水,铁和硫酸反应生成硫酸亚铁和氢气,铁离子和铁反应生成亚铁离子,亚铁离子易被氧化,充入氮气把装置中空气排净;趁热过滤得到硫酸亚铁溶液,向硫酸亚铁溶液中加入硫酸铵结晶析出摩尔盐.
(1)氮气化学性质稳定,不会参与化学反应,可以将其中的空气排净等;
(2)①检验氢氧化钡已足量,即检验硫酸根离子沉淀完全;根据沉淀溶解平衡常熟计算氢氧化钡的最低浓度;
②不溶于盐酸的白色固体13.98g为硫酸钡沉淀,据此可计算出硫酸根离子的物质的量,根据化学方程式6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O计算亚铁离子的物质的量,根据电荷守恒来计算铵根离子物质的量,根据质量守恒计算水的物质的量,算出各微粒的物质的量之比,进而写出摩尔盐的化学式.
(1)氮气化学性质稳定,不会参与化学反应,可以将其中的空气排净等;
(2)①检验氢氧化钡已足量,即检验硫酸根离子沉淀完全;根据沉淀溶解平衡常熟计算氢氧化钡的最低浓度;
②不溶于盐酸的白色固体13.98g为硫酸钡沉淀,据此可计算出硫酸根离子的物质的量,根据化学方程式6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O计算亚铁离子的物质的量,根据电荷守恒来计算铵根离子物质的量,根据质量守恒计算水的物质的量,算出各微粒的物质的量之比,进而写出摩尔盐的化学式.
解答:
解:(1)亚铁离子很易被空气氧化为三价铁离子,“反应I”中通入N2,可以防止Fe2+被氧化为Fe3+,同时通入时的气流会起搅拌作用,能加快反应速率,
故答案为:防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率;
(2)①氢氧化钡和硫酸铁铵反应生成硫酸钡沉淀和氢氧化铁沉淀及氨气,若氢氧化钡不足,则溶液中存在硫酸根离子,故继续加入氢氧化钡沉淀,若无沉淀生成,证明氢氧化钡过量,具体操作为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀,则说明氢氧化钡过量;
亚铁离子沉淀完全,c(Fe2+)=1.0×10-5mol/L,则此时c(OH-)=
=2.2×10-6;
硫酸根离子沉淀完全,c(SO42-)=1.0×10-5mol/L,则此时c(Ba2+)=
=1.1×10-5,故要使离子沉淀完全,残余氢氧化钡浓度不低于1.1×10-5,
故答案为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀;1.1×10-5;
②n(SO42-)=
=0.06 mol
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol?L-1×0.025L
n(Fe2+)=0.005 mol×6=0.03mol
根据电荷守恒得:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=
=0.18 mol,
n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 06 mol:0 03 mol:0 06mol:0 18 mol=2:1:2:6,故莫尔盐的化学式为:(NH4)2Fe(SO4)2?6H2O[或(NH4)2SO4?FeSO4?6H2O],
故答案为:(NH4)2Fe(SO4)2?6H2O[或(NH4)2SO4?FeSO4?6H2O].
故答案为:防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率;
(2)①氢氧化钡和硫酸铁铵反应生成硫酸钡沉淀和氢氧化铁沉淀及氨气,若氢氧化钡不足,则溶液中存在硫酸根离子,故继续加入氢氧化钡沉淀,若无沉淀生成,证明氢氧化钡过量,具体操作为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀,则说明氢氧化钡过量;
亚铁离子沉淀完全,c(Fe2+)=1.0×10-5mol/L,则此时c(OH-)=
|
硫酸根离子沉淀完全,c(SO42-)=1.0×10-5mol/L,则此时c(Ba2+)=
| 1.1×10-10 |
| 1.0×10-5 |
故答案为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀;1.1×10-5;
②n(SO42-)=
| 13.98g |
| 233g/mol |
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol?L-1×0.025L
n(Fe2+)=0.005 mol×6=0.03mol
根据电荷守恒得:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=
| ||
| 18g/mol |
n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 06 mol:0 03 mol:0 06mol:0 18 mol=2:1:2:6,故莫尔盐的化学式为:(NH4)2Fe(SO4)2?6H2O[或(NH4)2SO4?FeSO4?6H2O],
故答案为:(NH4)2Fe(SO4)2?6H2O[或(NH4)2SO4?FeSO4?6H2O].
点评:本题是一道关于物质分子式确定的计算题,考查学生的计算能力以及分析和解决问题的能力,综合性较强,难度大.在计算氢氧化钡浓度的最低浓度应按钡离子浓度计算氢氧化钡浓度,而不能按氢氧根离子浓度计算氢氧化钡浓度,计算摩尔盐的化学式时要注意分成两份,计算时要注意电荷守恒和质量守恒的应用.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列有关溶液组成的描述合理的是( )
| A、常温下,水电离出的c(H+)=1×10-12mol/L,某无色溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- |
| B、pH=2的溶液中,可能大量存在:Na+、Fe2+、ClO-、SO42- |
| C、常温下某溶液中KW/c(H+)=1×10-12,溶液中可能大量存在:Na+、NH4+、Cl-、HCO3- |
| D、某溶液中加入少量Al 有气体生成,溶液中可能大量存在:Na+、K+、Cl-、NO3- |
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
| A、当NH3、O2、NO、H2O浓度比为4:5:4:6时达到平衡 | ||
B、平衡时v正(O2)=
| ||
| C、平衡后减小压强,混合气体平均摩尔质量增大 | ||
| D、平衡后升高温度,混合气体中NO含量降低 |
某学生设计了如图的方法对X盐进行鉴别,由此分析,下列结论中正确的是( )
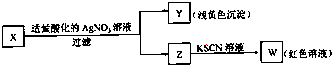

| A、加入适量酸化的AgNO3溶液只发生复分解反应 |
| B、X中一定有Fe3+ |
| C、将操作顺序调换,现象一致,可判断X为FeBr3 |
| D、X一定为FeBr2溶液 |
下列物质不属于天然高分子化合物的是( )
| A、淀粉 | B、纤维素 |
| C、油脂 | D、蛋白质 |