题目内容
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL: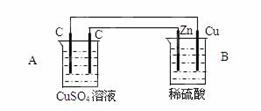
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,
电极反应式为 ;
A池中总反应化学方程式为 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计)。
(各2分,共10分)
(1)电解池;
(2)阳极,4OH--4e-=2H2O+O2↑; 2CuSO4+ 2H2O =" 2Cu" + O2+ H2SO4;(条件不扣分)
(3)0.9mol/L。
解析试题分析:(1)B装置存在自发的氧化还原反应,所以B池是原电池,则A池是电解池;
(2)B池中的Zn作原电池的负极,Cu作正极,则A池中的左边的石墨与正极相连,是电解池的阳极,硫酸铜溶液中的氢氧根离子放电生成氧气,电极反应式为4OH--4e-=2H2O+O2↑;右边的石墨作阴极,是铜离子放电生成单质Cu,所以电解池的总反应是2CuSO4+ 2H2O =" 2Cu" + O2+ H2SO4;
(3)导线上通过了0.04mol电子,则消耗铜离子的物质的量是0.04mol/2=0.02mol,原溶液中铜离子的物质的量是0.2L×1.0mol/L=0.2mol,所以溶液中剩余铜离子的物质的量是0.2-0.02=0.18mol,所以反应后A池c(Cu2+)为0.18mol/0.2L=0.9mol/L.
考点:考查对电化学装置的判断,电化学原理的应用,有关计算

我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi LixV2O5。下列说法正确的是
LixV2O5。下列说法正确的是
| A.该电池充电时,锂极与外电源的负极相连 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阴极的反应为:LixV2O5 -xe-=V2O5 + xLi+ |
| D.若放电时转移0.2 mol 电子,则用去的锂为1.4 x g |
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验装置 |  |  |  |  |
| 部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
下列有关电池叙述不正确的是( )
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |




