题目内容
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi LixV2O5。下列说法正确的是
LixV2O5。下列说法正确的是
| A.该电池充电时,锂极与外电源的负极相连 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阴极的反应为:LixV2O5 -xe-=V2O5 + xLi+ |
| D.若放电时转移0.2 mol 电子,则用去的锂为1.4 x g |
A
解析试题分析:根据总反应分析可得放电时负极反应为:xLi - xe-= xLi+,正极反应为:V2O5+ xe-= V2O5,A、充电时,锂极发生xLi++ xe-= xLi(还原反应),作阴极,与外电源的负极相连,正确; B、放电时,Li+向正极移动,错误;C、充电时阴极的反应为:xLi++ xe-= xLi,错误; D、放电时转移0.2 mol 电子,则用去的锂为0.2 mol,m(Li)=1.4g,错误。
考点:考查电化学相关知识。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
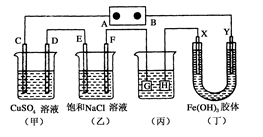
下列说法正确的是

| A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液 |
| B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝 |
| C.图③是用海水制取蒸馏水的装置 |
| D.图④装置可用于乙醇提取碘水中的碘 |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
| A.电解时,石墨作阳极,不锈钢作阴极 |
| B.电解时的阳极电极反应式:I-?6e-+3H2O = IO3-+6H+ |
| C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D.电解一段时间后,电解质溶液的pH变小 |
碘盐的主要成分是KIO3和NaCl,KIO3在工业上可用电解法制取,以石墨和铁为电极,电解KI溶液,反应方程式为KI+3H2O=KIO3 +3H2↑。下列有关说法中正确的是
| A.电解时,石墨作阴极,铁作阳极 |
| B.电解时,在阴极上产生KIO3 |
| C.电解后电解质溶液pH变大 |
| D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
下列有关电池叙述正确的是
| A.化学电池的反应本质是复分解反应 |
| B.铅蓄电池放电时,是电能转变为化学能的过程 |
| C.锌电锰干池碳棒是负极,锌片是正极 |
| D.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
原电池产生电流的本质原因是( )
| A.原电池中溶液能电离出自由移动的离子 |
| B.有两根导线将两个活泼性不同的电极连接 |
| C.电极上进行的氧化还原反应的生成物为电子 |
| D.电极上进行的氧化还原反应中会有电子的转移 |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |