题目内容
1.把锌片投人到盛有CH3COOH溶液的敞口容器里,改变下列条件,其中能加快反应速率的是( )| A. | 加入少量NaCl固体 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 加入少量水 | D. | 加入少量CH3COONa固体 |
分析 对于敞口容器里固体和溶液的反应,增大浓度、升高温度、使用催化剂以及原电池反应等可增大反应速率,以此解答该题.
解答 解:A.加入少量NaCl固体,氢离子浓度不变,反应速率不变,故A错误;
B.滴加少量硫酸铜溶液,锌置换出铜,形成原电池反应,反应速率增大,故B正确;
C.加入少量水,浓度减小,反应速率减小,故C错误;
D.加入少量CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减小,故D错误.
故选B.
点评 本题考查影响化学反应速率的常见因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意反把握反应的特征以及影响速率的因素.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
9.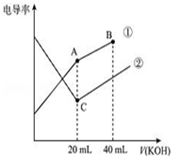 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)小于A点水电离的 c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
9.下列离子方程式的书写正确的是( )
| A. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| B. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na++2H2O |
6.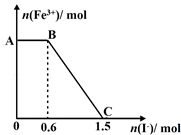 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 共有1molFeSO4被氧化 |
7.表是某橙汁饮料包装袋上的说明:
(1)配料中属于着色剂的是β-胡萝卜素
(2)该橙汁饮料含有(填“含有”或“不含”)防腐剂.
| 品名 | 浓缩橙汁 |
| 配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
| 鲜橙原汁含量 | ≥20% |
| 净含量 | 1.5L |
| 生产日期 | 标于瓶盖上 |
(2)该橙汁饮料含有(填“含有”或“不含”)防腐剂.
 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.