题目内容
设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、0.5mol O3 和11.2L O2的体积一定相等 |
| B、5.6 gFe与足量的稀盐酸充分反应后,转移的电子数为0.2NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、1L 0.1mol/L的醋酸溶液中H+数目为0.1 NA |
考点:阿伏加德罗常数
专题:
分析:A、只有标况下,气体摩尔体积=22.4L/mol才能使用;
B、铁与稀盐酸反应生成亚铁离子;
C、CO、C2H4的相对分子质量相同,据此解答即可;
D、醋酸属于弱电解质,存在电离平衡.
B、铁与稀盐酸反应生成亚铁离子;
C、CO、C2H4的相对分子质量相同,据此解答即可;
D、醋酸属于弱电解质,存在电离平衡.
解答:
解:A、只有标况下,气体摩尔体积=22.4L/mol才能使用,故0.5mol O3 的体积不一定是11.2L,故A错误;
B、铁与稀盐酸反应生成亚铁离子,即1molFe失去的电子数为2mol,5.6 gFe为0.1mol,与足量的稀盐酸充分反应后,转移的电子数为0.2NA,故B正确;
C、CO、C2H4的相对分子质量相同,标况下,两者的体积为22.4L,故两者物质的量之和为1mol,故m=nM=1mol×28=28g,故C正确;
D、1L 0.1mol/L的醋酸溶液和,醋酸的物质的量为:1L×0.1mol/L=0.1mol,但是醋酸属于弱电解质,存在电离平衡,故0.1mol醋酸中H+数目<0.1 NA,故D错误,故选AD.
B、铁与稀盐酸反应生成亚铁离子,即1molFe失去的电子数为2mol,5.6 gFe为0.1mol,与足量的稀盐酸充分反应后,转移的电子数为0.2NA,故B正确;
C、CO、C2H4的相对分子质量相同,标况下,两者的体积为22.4L,故两者物质的量之和为1mol,故m=nM=1mol×28=28g,故C正确;
D、1L 0.1mol/L的醋酸溶液和,醋酸的物质的量为:1L×0.1mol/L=0.1mol,但是醋酸属于弱电解质,存在电离平衡,故0.1mol醋酸中H+数目<0.1 NA,故D错误,故选AD.
点评:本题主要考查的是气体摩尔体积的使用条件、氧化还原反应原理、弱酸的电离等知识点,难度不大,属于高频考题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列概念分类标准正确的是( )
| A、酸和盐:电离时产生的阳离子是否有H+ |
| B、强电解质和弱电解质:溶液导电能力强弱 |
| C、浊液、胶体、溶液:是否具有丁达尔效应 |
| D、氧化剂、还原剂:反应中得失电子的情况 |
在制备蒸馏水的实验中,下列操作叙述不正确的是( )
| A、将温度计水银球插到蒸馏烧瓶的支管口处 |
| B、在蒸馏操作结束时,应先关掉冷凝水,再熄灭酒精灯 |
| C、冷水从冷凝管下口入,上口出 |
| D、收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
根据部分短周期元素的原子半径及主要化合价信息,下列判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
室温下,若溶液中由水电离产生c(OH-)=1×10-14 mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、K+、NH4+、SO42-、NO3- |
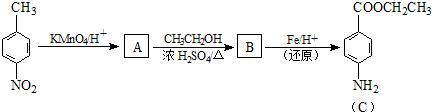
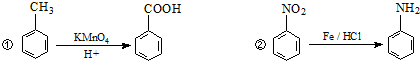
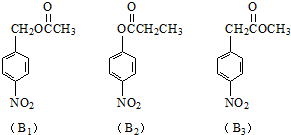
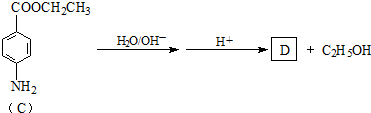
 实验室制氯气的实验装置图如下所示:
实验室制氯气的实验装置图如下所示: