题目内容
7.已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的基态原子有6个单电子;F位于ds区,最外能层有单电子;D与E不同周期,但最外能层电子数相等.(1)写出基态E原子的外围电子排布式3d54s1.
(2)A、B、C三种元素第一电离能由小到大的顺序为O<N<F(用元素符号表示).
(3)B、C两元素形成的化合物BC2的VSEPR模型名称为四面体形,已知BC2分子的极性比水分子的极性弱,其原因是FO2和H2O分子均为V形分子,且孤对电子均为2对,F与O的电负性差值较O与H的电负性差值小.
(4)写出由A和B两种元素形成的与A3-互为等电子体的粒子的化学式N2O、NO2+(分子和离子各写一种).
(5)B、E两元素形成的化合物EB5中E的化合价为+6价,则EB5的结构式为
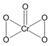 .
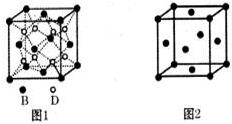
.(6)B、D形成的一种离子化合物的晶胞结构如图1,已知该晶胞的边长为acm,阿伏伽德罗常数为NA,晶胞的密度为ρ=$\frac{248}{{a}^{3}{N}_{A}}$g/cm3(用含a、NA的计算式表示)
(7)由F原子形成的晶胞结构如图2,设晶胞参数为b,列式表示F原子在晶胞中的空间利用率$\frac{\sqrt{2}}{6}π$(不要求计算结果).
分析 A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大;A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子且原子序数大于A,则C是F元素,B为O元素;
E的基态原子有6个单电子,则E为Cr元素;D与E不同周期,但最外能层电子数相等,则D为Na元素;
F位于ds区,最外能层有单电子,则F为Cu元素;结合题目分析解答.
解答 解:A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大;A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子且原子序数大于A,则C是F元素,B为O元素;
E的基态原子有6个单电子,则E为Cr元素;D与E不同周期,但最外能层电子数相等,则D为Na元素;
F位于ds区,最外能层有单电子,则F为Cu元素;
(1)基态E原子的价电子排布式为3d54s1,故答案为:3d54s1;
(2)A、B、C三种元素分别是N、O、F元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能O<N<F,
故答案为:O<N<F;
(3)B、C两元素形成的化合物FO2中F原子孤电子对数=$\frac{7-2×2}{2}$=1.5,应看作2对孤对电子,价层电子对数为4,VSEPR模型名称为四面体形,FO2和H2O分子均为V形分子,且孤对电子均为2对,F与O的电负性差值较O与H的电负性差值小,OF2分子的极性比水分子的极性弱,
故答案为:四面体形;FO2和H2O分子均为V形分子,且孤对电子均为2对,F与O的电负性差值较O与H的电负性差值小;
(4)由N和O两种元素形成的与N3-互为等电子体的粒子的化学式有N2O、NO2+等,
故答案为:N2O、NO2+;
(5)O、Cr两元素形成的化合物CrO5中Cr的化合价为+6价,该化学式中有1个O原子化合价为-2价、其余四个O原子化合价为-1价,则EB5的结构式为 ,
,
故答案为: ;
;
(6)晶胞中白色球数目为8,黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该化合物为Na2O,晶胞质量为4×$\frac{62}{{N}_{A}}$g,则晶胞密度为4×$\frac{62}{{N}_{A}}$g÷(acm)3=$\frac{248}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{248}{{a}^{3}{N}_{A}}$;
(7)晶胞中E原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,设E原子半径为r,则4r=$\sqrt{2}$b,故原子半径r=$\frac{\sqrt{2}}{4}$b,则E原子在晶胞中的空间利用率为$\frac{4×\frac{3}{4}π×(\frac{\sqrt{2}}{4}b)^{3}}{{b}^{3}}$=$\frac{\sqrt{2}}{6}π$,故答案为:$\frac{\sqrt{2}}{6}π$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、原子核外电子排布、第一电离能大小比较等知识点,侧重考查学生分析判断、计算、空间想象能力,难点是晶胞计算,注意(7)题哪几个原子紧密相连,为易错点.

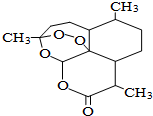 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )| A. | 青蒿素能与热的NaOH溶液反应 | B. | 青蒿素的分子式为C15H21O5 | ||
| C. | 青蒿素分子结构中只含有极性键 | D. | 青蒿素能使酸性KMnO4溶液褪色 |
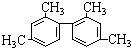 的烃的下列说法不正确的是( )
的烃的下列说法不正确的是( )| A. | 分子式为C16H18 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 属于苯的同系物 | |
| D. | 一氯代物存在5种同分异构体 |
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.05molH2O2中含有的阴离子数为0.05NA | |
| C. | 3mol单质Fe与足量水蒸气在一定条件下反应失去9NA 个电子 | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
 的一氯代物有(不考虑立体异构)( )
的一氯代物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
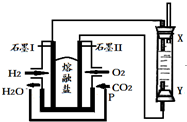 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.