题目内容
氧化铜是一种黑色固体,可溶于稀硫酸.某学习小组为研究是稀硫酸中的哪种粒子(H2O,H+,SO42-)使氧化铜溶解,进行如下探究活动.甲同学设计如图Ⅰ、Ⅱ和Ⅲ三个实验以完成本次探究活动.
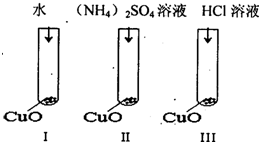
(1)甲同学提出的假设是 .
(2)通过实验I可以证明 .
(3)其实验Ⅱ的目的是验证SO42-是否使CuO溶解,乙同学认为实验Ⅱ不管现象如何,都无法达到预期的目的,并指出用Na2SO4代替(NH4)2SO4即可解决这一问题,其理由是
.
(4)探究结果为 .
(5)丙同学认为经过乙同学对实验Ⅱ改进后,可以不做实验Ⅰ,同时指出实验Ⅲ的设计也存在不足,他认为把实验Ⅰ中的水换成另外一种试剂即可解决问题,这种试剂是 .

(1)甲同学提出的假设是
(2)通过实验I可以证明
(3)其实验Ⅱ的目的是验证SO42-是否使CuO溶解,乙同学认为实验Ⅱ不管现象如何,都无法达到预期的目的,并指出用Na2SO4代替(NH4)2SO4即可解决这一问题,其理由是
(4)探究结果为
(5)丙同学认为经过乙同学对实验Ⅱ改进后,可以不做实验Ⅰ,同时指出实验Ⅲ的设计也存在不足,他认为把实验Ⅰ中的水换成另外一种试剂即可解决问题,这种试剂是
考点:性质实验方案的设计,常见离子的检验方法
专题:实验设计题
分析:(1)实验目的是研究稀硫酸中的哪种粒子,H2O、H+、SO42-中的某一种粒子能够使CuO溶解;
(2)实验Ⅰ证明水不能溶解氧化铜;
(3)加入硫酸铵使强酸弱碱盐,溶液中有硫酸根离子,也有铵根离子水解生成的氢离子,不能证明铵根离子是否溶解氧化铜,用硫酸钠代替硫酸铵可以达到目的;
(4)分析实验现象可知溶解氧化铜的是氢离子;
(5)实验Ⅲ加入盐酸除氢离子,还有氯离子可能溶解氧化铜,所以水可以换成氯化钠不溶证明;
(2)实验Ⅰ证明水不能溶解氧化铜;
(3)加入硫酸铵使强酸弱碱盐,溶液中有硫酸根离子,也有铵根离子水解生成的氢离子,不能证明铵根离子是否溶解氧化铜,用硫酸钠代替硫酸铵可以达到目的;
(4)分析实验现象可知溶解氧化铜的是氢离子;
(5)实验Ⅲ加入盐酸除氢离子,还有氯离子可能溶解氧化铜,所以水可以换成氯化钠不溶证明;
解答:
解:(1)实验目的是研究稀硫酸中H2O、H+、SO42-中的哪种粒子能够使CuO溶解;
故答案为:H2O、H+、SO42-中的某一种粒子能够使CuO溶解;
(2)实验Ⅰ证明水不能溶解氧化铜,可能是H+、SO42-中的一种粒子使氧化铜溶解;
故答案为:水不能使氧化铜溶解,是H+、SO42-中的一种粒子使CuO溶解
(3)加入硫酸铵使强酸弱碱盐,溶液中有硫酸根离子,也有铵根离子水解生成的氢离子,不能证明铵根离子是否溶解氧化铜,用硫酸钠代替硫酸铵可以达到目的,证明硫酸根离子是否溶解氧化铜;
故答案为:(NH4)2SO4溶液是强酸弱碱盐,溶液既有SO42-,也有水解产生的H+;
(4)水中不溶,硫酸铵和盐酸中溶解,分析实验现象可知溶解氧化铜的是氢离子的作用;
故答案为:氧化铜溶于稀硫酸是氢离子在起作用而不是H2O、SO42-
(5)实验Ⅲ加入盐酸除氢离子,还有氯离子可能溶解氧化铜,所以实验Ⅰ加入的水可以换成氯化钠,氧化铜不溶可以排除氯离子,同时证明水不能溶解氧化铜;
故答案为:NaCl溶液;
故答案为:H2O、H+、SO42-中的某一种粒子能够使CuO溶解;
(2)实验Ⅰ证明水不能溶解氧化铜,可能是H+、SO42-中的一种粒子使氧化铜溶解;
故答案为:水不能使氧化铜溶解,是H+、SO42-中的一种粒子使CuO溶解
(3)加入硫酸铵使强酸弱碱盐,溶液中有硫酸根离子,也有铵根离子水解生成的氢离子,不能证明铵根离子是否溶解氧化铜,用硫酸钠代替硫酸铵可以达到目的,证明硫酸根离子是否溶解氧化铜;
故答案为:(NH4)2SO4溶液是强酸弱碱盐,溶液既有SO42-,也有水解产生的H+;
(4)水中不溶,硫酸铵和盐酸中溶解,分析实验现象可知溶解氧化铜的是氢离子的作用;
故答案为:氧化铜溶于稀硫酸是氢离子在起作用而不是H2O、SO42-
(5)实验Ⅲ加入盐酸除氢离子,还有氯离子可能溶解氧化铜,所以实验Ⅰ加入的水可以换成氯化钠,氧化铜不溶可以排除氯离子,同时证明水不能溶解氧化铜;
故答案为:NaCl溶液;
点评:本题考查了氧化铜溶于酸的反应实质理解,实验设计方法和离子性质的分析判断是关键,题目难度中等.

练习册系列答案
相关题目
对电解质的叙述正确的是( )
| A、溶于水后得到的溶液能导电的物质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、KNO3是电解质故KNO3晶体能导电 |
| D、二氧化碳的水溶液能导电,但二氧化碳不是电解质 |
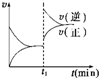 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )| A、2SO2(g)+O2(g)?2SO3(g)△H< |
| B、4 NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、H2(g)+I2(g)?2HI(g)△H>0 |
| D、2 NH3(g)?N2(g)+3H2(g)△H>0 |
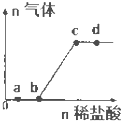 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、OH-、SO42-、NO3- |
| B、b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
 已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.