题目内容
气体A由两短周期元素甲、乙组成,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液能使石蕊试液褪色,在放置过程中其酸性会增强.常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气的主要成分之一.一定条件下,气体A可用甲单质与潮湿的Na2CO3反应制得,同时只生成两种钠盐.请回答下列问题:
(1)乙元素在周期表中的位置为 ,气体A的化学式为 ;
(2)用化学方程式表示B溶液酸性增强的原因 ;
(3)气体A与NH3反应的化学方程式为 ;
(4)试写出制取气体A的化学方程式为 .
(1)乙元素在周期表中的位置为
(2)用化学方程式表示B溶液酸性增强的原因
(3)气体A与NH3反应的化学方程式为
(4)试写出制取气体A的化学方程式为
考点:无机物的推断
专题:
分析:某含氯化合物A由两种短周期元素组成,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气的主要成分之一,根据元素守恒知D为N2,常见液体E为H2O,根据元素守恒可知,A为氯的氧化物,测得A气体对空气的相对密度为3.0,则其相对分子质量为3×29=87,故A分子中Cl原子数目为偶数,只能为2,则含有氧原子数目=
=1,故A为Cl2O,可推知离子化合物C为NH4Cl,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强,B为HClO,气体A可用甲单质与潮湿的Na2CO3反应制得,同时生成两种钠盐,由元素守恒可知,该单质气体为Cl2,则甲是Cl元素,则乙是O元素,生成的两种钠盐只能为NaHCO3、NaCl,据此解答.
| 87-35.5×2 |
| 16 |
解答:
解:某含氯化合物A由两种短周期元素组成,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气的主要成分之一,根据元素守恒知D为N2,常见液体E为H2O,根据元素守恒可知,A为氯的氧化物,测得A气体对空气的相对密度为3.0,则其相对分子质量为3×29=87,故A分子中Cl原子数目为偶数,只能为2,则含有氧原子数目=
=1,故A为Cl2O,可推知离子化合物C为NH4Cl,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强,B为HClO,气体A可用甲单质与潮湿的Na2CO3反应制得,同时生成两种钠盐,由元素守恒可知,该单质气体为Cl2,则甲是Cl元素,则乙是O元素,生成的两种钠盐只能为NaHCO3、NaCl,
(1)通过以上分析知,乙是O元素,位于第二周期第VIA族,A的化学式为Cl2O,故答案为:第二周期第VIA族;Cl2O;
(2)B在溶液发生反应:2HClO
2HCl+O2↑,生成HCl,酸性增强,故答案为:2HClO
2HCl+O2↑;
(3)气体A与NH3反应的化学方程式为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,故答案为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O;
(4)Cl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,
故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
| 87-35.5×2 |
| 16 |
(1)通过以上分析知,乙是O元素,位于第二周期第VIA族,A的化学式为Cl2O,故答案为:第二周期第VIA族;Cl2O;
(2)B在溶液发生反应:2HClO
| ||
| ||
(3)气体A与NH3反应的化学方程式为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,故答案为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O;
(4)Cl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,
故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
点评:本题考查了物质的推断、实验方案设计,侧重考查学生对知识的综合应用及逻辑能力,知道铵根离子检验方法,为常考查点,题目难度中等.

练习册系列答案
相关题目
下列各组物质中,互为同素异形体的是( )
| A、红磷和白磷 |
| B、甲烷和乙烷 |
| C、1H和2H |
| D、K和K+ |
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
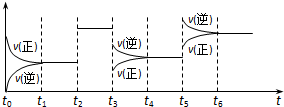

| A、t5时增大了压强 |
| B、t3时降低了温度 |
| C、t2时加入了催化剂 |
| D、t4~t5时间内转化率一定最低 |
下列物质反应过程中不会产生气体的是( )
A、 |
B、 |
C、 |
D、 |
在一密闭容器中,反应 aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
| A、平衡向正反应方向移动了 |
| B、平衡向逆反应方向移动了 |
| C、物质B的质量分数增大了 |
| D、b>a |
据新浪网报道,欧洲一集团公司拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢.有下列几种说法:
①水分解反应是放热反应;
②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;
③使用氢气作燃料有助于控制温室效应;
④氢气是一级能源.
其中叙述正确的是( )
①水分解反应是放热反应;
②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;
③使用氢气作燃料有助于控制温室效应;
④氢气是一级能源.
其中叙述正确的是( )
| A、①② | B、③④ |
| C、②③ | D、①②③④ |
沼气是一种能源,它主要是CH4,常温下0.5mol CH4完全燃烧生成CO2和H2O时,放出445kJ的热量,则下列热化学方程式中正确的是( )
| A、2 CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890kJ/mol |
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890kJ/mol |
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol |
| D、0.5CH4(g)+O2(g)=0.5CO2(g)+H2O(l);△H=-890kJ/mol |
