题目内容
16.下列有关氯化铁溶液的性质所涉及的离子方程式不正确的是( )| A. | 用作净水剂:Fe3++H2O?Fe(OH)3+3H+ | |
| B. | 用于制印刷电路的腐蚀液:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 与小苏打溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ | |
| D. | 遇KSCN 溶液变红色:Fe3++3SCN-═Fe(SCN)3↓ |
分析 A.铁离子水解生成具有吸附性的氢氧化铁;
B.铁离子具有氧化性,可氧化铜;
C.铁离子与碳酸氢根离子发生互促水解反应;
D.铁离子与KSCN发生络合反应,溶液变为红色.
解答 解:A.铁离子水解生成具有吸附性的氢氧化铁,离子方程式为Fe3++H2O?Fe(OH)3+3H+,生成的Fe(OH)3可起到净水作用,故A正确;
B.铁离子具有氧化性,可氧化铜,反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.铁离子与碳酸氢根离子发生互促水解反应,生成氢氧化铁沉淀和二氧化碳气体,方程式为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,故C正确;
D.铁离子与KSCN发生络合反应,溶液变为红色,但没有生成沉淀,离子方程式为Fe3++3SCN-═Fe(SCN)3,故D错误.
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,侧重考查学生的分析能力,明确反应实质及离子方程式书写方法是解题关键,本题注意把握铁离子的性质,题目难度不大.

练习册系列答案
相关题目
6.下列各组物质按化合物、单质、混合物、电解质、非电解质排列的是( )
| A. | 烧碱、液态氧、碘酒 NaCl、酒精 | |
| B. | 生石灰、白磷、熟石灰 熔融NaCl、BaSO4 | |
| C. | 干冰、铁、氯化氢 铜、二氧化硫 | |
| D. | 空气、氮气、胆矾 熔融的KNO3、硫酸溶液 |
7.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示:
①b<f
②915℃、2.0MPa时E的转化率为60%
③该反应的△S<0
④K(815℃)<K(1000℃)
上述①~④中不正确的有( )
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 20 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
②915℃、2.0MPa时E的转化率为60%
③该反应的△S<0
④K(815℃)<K(1000℃)
上述①~④中不正确的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
4.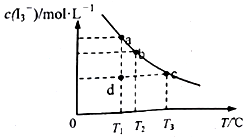 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )| A. | 温度为T1时,向该平衡体系中加入KI固体,平衡正向移动 | |
| B. | 反应I2(aq)+I-(aq)═I3-(aq)△H<0 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更高 |
11.下列操作和结论正确的是( )
| A. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解 | |
| B. | NaAlO2 溶液中滴加 Na2 CO3 溶液,有沉淀和气体生成 | |
| C. | 将 SO2 分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中产生的沉淀成分不同 | |
| D. | 用铂丝蘸取少量试液进行焰色反应,火焰呈黄色的一定是钠盐溶液 |
1.下列叙述不正确的是( )
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪经) | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
19.某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质.
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→A、B→C、D→E:广口瓶Ⅱ中的试剂为饱和食盐水.
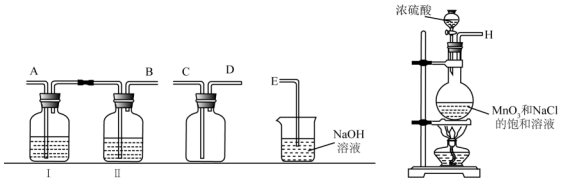
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)某学生设计如下实验进一步探究SO2与漂粉精的反应:
①pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
②该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是排除氯气干扰
③推测ii中溶液变为黄绿色,是由于产生了Cl2(写化学式),iii中产生的大量白色沉淀应为CaSO4(写化学式)
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→A、B→C、D→E:广口瓶Ⅱ中的试剂为饱和食盐水.

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
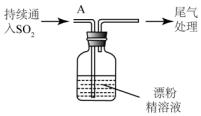 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
②该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是排除氯气干扰
③推测ii中溶液变为黄绿色,是由于产生了Cl2(写化学式),iii中产生的大量白色沉淀应为CaSO4(写化学式)
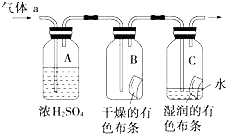 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题: 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: