题目内容
设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A、在常温常压下,11.2L氯气中含有的分子数为NA |
| B、2L 0.5mol?L-1 Na2SO4溶液中含有的Na+数为NA |
| C、在常温常压下,1mol NH3含有的原子数为4NA |
| D、2g H2中含有的电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据气体摩尔体积的条件应用分析;
B、依据n=CV,结合溶质完全电离出钠离子计算离子数;
C、结合氨气分子式计算原子数;
D、依据n=
=1mol,结合分子式计算电子数;
B、依据n=CV,结合溶质完全电离出钠离子计算离子数;
C、结合氨气分子式计算原子数;
D、依据n=
| 2g |
| 2g/mol |
解答:
解:A、在常温常压下,11.2L氯气物质的量不是0.5mol,故A错误;
B、依据n=CV,计算得到溶质硫酸钠物质的量=2L×0.5mol/L=1mol,溶质完全电离出钠离子数2NA,故B错误;
C、结合氨气分子式计算原子数,在常温常压下,1mol NH3含有的原子数为4NA,故C正确;
D、依据n=
=1mol,结合氢气分子式计算电子数2NA,故D错误;
故选C.
B、依据n=CV,计算得到溶质硫酸钠物质的量=2L×0.5mol/L=1mol,溶质完全电离出钠离子数2NA,故B错误;
C、结合氨气分子式计算原子数,在常温常压下,1mol NH3含有的原子数为4NA,故C正确;
D、依据n=
| 2g |
| 2g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,溶质物质的量计算,分子结构的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
 如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )
如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )| A、原子半径X>Y |
| B、最高价氧化物对应的水化物酸性X>Y |
| C、X的氢化物具有强还原性 |
| D、Y与碘同周期,Y最高价氧化物对应的水化物酸性比高碘酸(HIO4)强 |
下列各图所示的实验原理、方法、装置或操作正确的是( )
A、 称取固体质量 |
B、 收集NO气体 |
C、 配制溶液 |
D、 制取氨 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、标准状况下,28g氮气所含有的原子数目为NA |
| B、常温常压下,44.8L氯化氢气体所含的分子数为2NA |
| C、标准状况下,22.4L水中含有NA个水分子 |
| D、常温常压下,2.3 g Na+中含有的电子数为NA |
下列离子方程式书写正确的是( )
| A、Cl2通入Na2SO3溶液:2Cl2+H2O+SO32-═2HClO+SO2↑+2Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
C、水杨酸(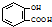 )中加入Na2CO3溶液: )中加入Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| D、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ |



