题目内容
5.关于分液漏斗的使用,下列说法正确的是( )| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 |
分析 分液漏斗用于分离互不相溶的液体,分液时应先检查溶液是否漏水,可检验瓶塞和旋塞,为充分萃取,在分液漏斗中加入萃取剂后应用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,使两种液体充分接触,并将分液漏斗下端紧贴烧杯内壁,防止液体迸溅,且上层液体从上口倒出,下层液体从下端流出,以此解答该题.
解答 解:A.酒精与四氯化碳混溶,不能用四氯化碳萃取碘酒中的碘,故A错误;
B.分液漏斗带有带有玻璃塞和活塞,用来分离互不相溶的液体,使用前必须应检漏,检查塞处和瓶口处,故B错误;
C.在分液漏斗中加入萃取剂后应用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,使两种液体充分接触,振荡后打开活塞,将漏斗内气体放出,故C错误;
D.分液时下层液体从下端流出,打开上方的玻璃塞,可保证液体顺利流下,故D正确.
故选D.
点评 本题考查物质的分离、提纯,侧重于分液的考查,注意把握分液的操作方法以及注意事项,学习中注意相关基础的积累,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
15.下列叙述正确的是( )
| A. | 1 mol氢为2 g | B. | H2O的摩尔质量为18 g | ||
| C. | 44 g CO2的体积为22.4 L | D. | 9.8 g H2SO4含0.1NA个H2SO4分子 |
16.向下列物质的溶液中通入CO2,不发生反应的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2SiO3 | D. | CaCl2 |
13.下列关于氧化还原反应的叙述中正确的是( )
| A. | 失去电子的反应为还原反应 | |
| B. | 含有氧元素的物质是氧化剂 | |
| C. | 氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
20.电离常数是衡量弱电解质电离程度强弱的物理量.已知:
(1)25℃时,有等浓度的:①NaCN溶液,②Na2CO3溶液,③CH3COONa溶液,
三溶液的pH由大到小的顺序为②>①>③.(填序号)
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2═HCN+NaHCO3.
(3)下图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是B

| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 一氯乙酸 | K=1.4×10-3 |
三溶液的pH由大到小的顺序为②>①>③.(填序号)
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2═HCN+NaHCO3.
(3)下图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是B

10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
17.X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如表:
(1)W的原子结构示意图为 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
(2)X与氢两元素按原子数目比1:3构成分子A,A的电子式为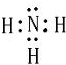 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的气态氢化物的稳定性比X的气态氢化物的稳定性若(填“强”或“弱”).
(4)检验溶液中R3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色.
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).(2)X与氢两元素按原子数目比1:3构成分子A,A的电子式为
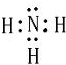 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的气态氢化物的稳定性比X的气态氢化物的稳定性若(填“强”或“弱”).
(4)检验溶液中R3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色.
15.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 碱金属单质都能在氧气中燃烧生成过氧化物 | |
| B. | N、O、F氢化物的稳定性依次减弱 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
