题目内容
2.25℃时,现有浓度均为0.10mol/L的2种溶液:①氨水、②氯化铵溶液.请回答:
(1)两种溶液中c(H+)>c(OH-)的是②(填序号).
(2)一水合氨的电离方程式是NH3•H2O?NH4++H+.
(3)下列说法正确的是c(填字母).
a.①和②中水的电离均被抑制
b.①中由水电离出的c(H+)=1.0×10-13mol/L
c.若两溶液等体积混合后pH>7,则溶液中离子浓度存在关系:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(4)用石墨作电极电解②时,阳极反应式是4OH--4e-2H2O+O2↑.
分析 (1)①氨水因为电离出氢氧根离子而显碱性,②氯化铵溶液中铵根离子水解溶液显酸性;
(2)一水合氨是弱电解质,不能完全电离;
(3)a.②氯化铵溶液中铵根离子水解溶液显酸性,促进水的电离;①氨水抑制水电离;
b.②氯化铵溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,常温下水电离出的c(OH-)=c(H+)=1.0×10-7mol/L,由水电离出的c(H+)>1.0×10-7mol/L,①氨水常温下水电离出的c(OH-)=c(H+)<1.0×10-7mol/L,
c.若两溶液等体积混合后pH>7,c(OH-)>c(H+),依据溶液中离子存在的电荷守恒关系为c(NH4+)+c(H+)=c(Cl-)+c(OH-)计算判断;
(4)惰性电极电解氯化铵溶液,在电解池的阳极上是溶液中阴离子失电子发生氧化反应.
解答 解:(1)①氨水因为电离出氢氧根离子而显碱性,②氯化铵溶液中铵根离子水解溶液显酸性;两种溶液中c(H+)>c(OH-),显示酸性的是②,故答案为:②;
(2)一水合氨是弱电解质,不能完全电离,电离方程式为:NH3•H2O?NH4++H+,故答案为:NH3•H2O?NH4++H+;
(3)a.②氯化铵溶液中铵根离子水解溶液显酸性,促进水的电离;①氨水抑制水电离,故错误;
b.氯化铵溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,常温下水电离出的c(OH-)=c(H+)=1.0×10-7mol/L,由水电离出的c(H+)>1.0×10-7mol/L,故错误;
c.若两溶液等体积混合后pH>7,c(OH-)>c(H+),依据溶液中离子存在的电荷守恒关系为c(NH4+)+c(H+)=c(Cl-)+c(OH-),得到c(NH4+)>c(Cl-)>c(OH-)>c(H+),故正确;故选c;
(4)惰性电极电解氯化铵溶液,在电解池的阳极上是溶液中阴离子失电子发生氧化反应,即4OH--4e-2H2O+O2↑,故答案为:4OH--4e-2H2O+O2↑.
点评 本题涉及弱电解质的电离以及盐的水解等方面的知识,溶液中电荷守恒,影响水的电离平衡因素的分析判断,注意知识的归纳和梳理是解题的关键,题目难度中等.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | S2-的结构示意图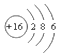 | B. | NH3结构式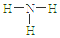 | C. | CO2的电子式: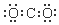 | D. | HCl电子式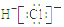 |
| A. | 青铜 | B. | 水银 | C. | 硬铝 | D. | 碳素钢 |
| A. | Ag+ H+ NO3- Cl- | B. | Ca2+ NO3- HCO3- Cl- | ||
| C. | K+ H+ Cl- SO42- | D. | Ca2+ Cl-SO42- CO32- |
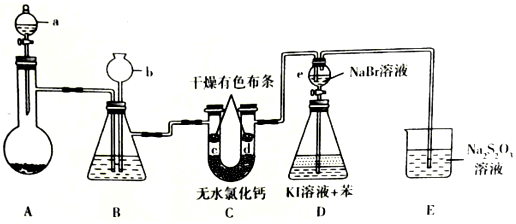
| A. | 分液 蒸馏 | B. | 过滤 蒸发 | ||
| C. | 萃取 分液 | D. | 萃取 分液 蒸馏 |
| A. | 高锰酸钾在常用危险化学品分类中属于易燃固体 | |
| B. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 | |
| C. | 做蒸发结晶实验时,用坩埚钳夹持热蒸发皿直接放于实验台面上 | |
| D. | 做分液操作时,待液体分层将下层液体从下口放出后,上层液体从上口倒出 |
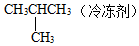
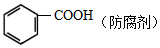 ⑥
⑥