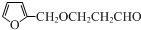题目内容
11.某温度下,在1L的密闭容器中,加入1molA(g)和2molB(g)发生反应:A(g)+b B(g)?3C(g)平衡时,A、B、C的体积分数分别为30%、60%、10%.在此平衡体系中加入1molC(g),再次达到平衡后,A、B、C的体积分数不变.下列叙述不正确的是( )| A. | b=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | A与B的平衡转化率之比为1:2 | |
| D. | 第二次平衡时,C的浓度为0.4 mol•L-1 |
分析 A.达到平衡体系中再加入1molC(g),重新达到平衡后A、B、C的体积分数不变,说明压强不影响化学平衡,则反应前后气体的总计量数相等,即:b+1=3;
B.由于温度不变,化学平衡常数不变;
C.根据加入A、B的物质的量与反应计量数之比都是1:2分析;
D.压强不影响化学平衡,反应前后气体总物质的量、各物质的百分含量不变,重新达到平衡时C的物质的量为:(1+2+1)mol×10%=0.4mol,然后根据c=$\frac{n}{V}$计算第二次平衡时C的浓度.
解答 解:A.在此平衡体系中加入1molC(g),再次达到平衡后,A、B、C的体积分数不变,说明压强不影响化学平衡,则b+1=3,即b=2,故A正确;
B.由于温度不变,则化学平衡常数不变,所以两次平衡的平衡常数相同,故B正确;
C.由于加入A、B的物质的量与反应计量数之比都是1:2,则A与B的平衡转化率相等,故C错误;
D.由于压强不影响化学平衡,反应前后气体总物质的量、各物质的百分含量不变,则重新达到平衡时C的物质的量为:(1+2+1)mol×10%=0.4mol,所以第二次平衡时,C的浓度为$\frac{0.4mol}{1L}$=0.4 mol•L-1,故D正确;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,正确判断计量数b的数值为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
2.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.已知镍镉电池的电解质溶液是KOH溶液,放电时的电池反应是:Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2,下列说法正确的是( )
| A. | 放电时电解质溶液的密度减小 | B. | 放电时K+向Cd极区移动 | ||
| C. | 充电时阳极Cd元素被氧化 | D. | 充电时阴极附近的pH增大 |
19.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4S24P5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1I、II所示:
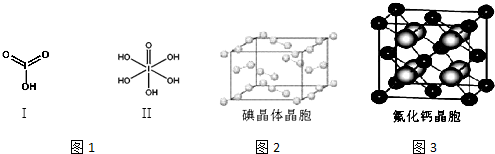
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O.
(6)图2为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图3)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4S24P5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O.
(6)图2为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图3)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
16.下列物质只含有共价键的化合物是( )
| A. | N2 | B. | NaOH | C. | H2O | D. | Ar |
3.下列实验操作中错误的是( )
| A. | 进行蒸发操作时,当溶液中出现较多固体时即可停止加热 | |
| B. | 进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
20.下列实验操作或叙述正确的是(填序号)( )
| A. | 乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 | |
| B. | 将无水乙醇和浓硫酸按体积比3:1混合,加热至170℃制取乙烯 | |
| C. | 蔗糖水解用浓硫酸作催化剂 | |
| D. | 油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来 |
1.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A. | 离子半径:S2->Cl->Ca2+ | B. | 还原性:I->Br->Cl- | ||
| C. | 热稳定性:HCl>H2S>H2Se | D. | 酸性:HClO4<HBrO4<HIO4 |

 +NaOH$\stackrel{H_{2}O}{→}$
+NaOH$\stackrel{H_{2}O}{→}$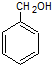 +NaCl,反应类型为取代反应.
+NaCl,反应类型为取代反应. .
. .
.