题目内容
19.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4S24P5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O.
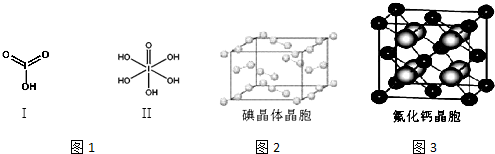
(6)图2为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图3)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)根据氢键分析解答,HF分子之间存在氢键,使氢氟酸分子缔合;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)碘为分子晶体,晶胞中占据顶点和面心,以此分析;
(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.
解答 解:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5,
故答案为:p;4s24p5;
(2)F是非金属性最强的元素,所以HF分子间易形成氢键,所以使氢氟酸分子缔合的作用力是氢键,
故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,
故答案为:碘;
(4)根据碘酸和高碘酸的结构式及分子式可知,碘酸可写成(HO)IO2,有2个非羟基O原子,而高碘酸可写成(HO)5IO,只有1个非羟基O原子,非羟基O原子越多,I的正电性越高,导致I-O-H中O原子的电子向I偏移,越容易打理出氢离子,所以碘酸的酸性大于高碘酸的酸性,
故答案为:>;
(5)ClO2-中心氯原子的价层电子对数是2+1/2(7+1-4)=4,所以杂化轨道类型是sp3,ClO2-的等电子体中含有3个原子、20个价电子,所以其等电子体是Cl2O或OF2
故答案为:sp3; Cl2O 或OF2;
(6)A.碘分子的排列有2种不同的取向,分别是顶点和面心,每种取向的碘分子距离最近且相等的碘分子数都是4个,等于面对角线的一半,交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有8×1/8+6×1/2=4个碘分子,有8个碘原子,故B错误;
C.构成碘晶体的微粒是碘分子,微粒间的作用力是分子间作用力,所以是分子晶体,不是原子晶体,故C错误;
D.碘晶体中碘原子之间是非极性共价键,碘分子间是范德华力,故D正确;
故答案为:AD;
(7)根据均摊法,晶胞中红球的个数是8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,黄球的个数8个,所以红色球代表钙离子,黄色球代表氟离子,棱上相邻的两个Ca2+的核间距为a cm,即晶胞的棱长为acm,设氟化钙的相对分子质量是M,则晶胞体积V=a3,CaF2密度为ρ=$\frac{m}{V}$=$\frac{M×4}{V{N}_{A}}$,则CaF2的相对分子质量M=$\frac{{a}^{3}ρ{N}_{A}}{4}$,
故答案为:$\frac{{a}^{3}ρ{N}_{A}}{4}$.
点评 本题考查物质结构与性质,涉及元素周期表、核外电子排布、分子结构与性质、电离能、杂化轨道、等电子体等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难度中等.

| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物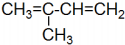 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
①一份中加入适量KMnO4溶液,红色褪去;
②向另一份中通入SO2,红色也褪去.
以下推测肯定不正确的是( )
| A. | ②中红色褪去的原因是SO2将SCN-还原 | |
| B. | ①中红色褪去的原因是KMnO4将SCN-氧化 | |
| C. | ②中红色褪去的原因是SO2将Fe3+还原成Fe2+ | |
| D. | SCN-在适当条件下可失去电子被氧化为(SCN)2 |
| A. | 氧化铜跟硝酸反应 Cu2++O2-+2H+═Cu+H2O | |
| B. | 碳酸镁跟硝酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | 铜跟稀硝酸反应 Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 铁跟浓硝酸共热 Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
| A. | 加Al放出H2的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | 由水电离出的c(OH-)=1.0×10-2 mol•L-1的溶液:Cl-、CH3COO-、K+、AlO2- | |
| C. | 水电离出的c(H+)=$\sqrt{Kw}$的溶液中:Na+、SO42-、CO32-、K+ | |
| D. | $\frac{c(OH-)}{c(H+)}$=1012的溶液中,NH4+、Al3+、NO3-、Cl- |
| A. | b=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | A与B的平衡转化率之比为1:2 | |
| D. | 第二次平衡时,C的浓度为0.4 mol•L-1 |
| A. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | |
| B. | 将少量硝酸银溶液滴入氨水中:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 铝粉与NaOH的溶液反应:2Al+2OH-═AlO2-+H2↑ |


 .
. .
.
 ,F1和F2互为同分异构体,G1和G2互为同分异构体.请填空:
,F1和F2互为同分异构体,G1和G2互为同分异构体.请填空: .
.