题目内容
13.今有Cl2、Fe、盐酸、Fe(NO3)2溶液、漂白粉固体等反应物,发生氧化还原反应.请按下列要求写出反应的离子方程式.
(1)一种单质氧化一种阳离子2Fe2++Cl2=2Fe3++2Cl-;
(2)一种单质还原一种阳离子Fe+2H+=Fe2++H2↑;
(3)一种阴离子氧化一种阳离子3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)一种阴离子氧化一种阴离子Cl-+ClO-+2H+=Cl2↑+H2O.
分析 (1)亚铁离子具有还原性,与氯气发生氧化还原反应;
(2)盐酸溶液中的氢离子与活泼的金属单质;
(3)阴离子硝酸根离子在酸性条件下具有氧化性,氧化还原的亚铁离子;
(4)次氯酸根离子与氯离子在酸性条件下发生氧化还原反应.
解答 解:(1)亚铁离子具有还原性,与氯气发生氧化还原反应,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)盐酸溶液中的氢离子与活泼的金属单质,离子反应方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)阴离子硝酸根离子在酸性条件下具有氧化性,氧化还原的亚铁离子,离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)次氯酸根离子与氯离子在酸性条件下发生氧化还原反应,离子反应方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,故答案为:Cl-+ClO-+2H+=Cl2↑+H2O.
点评 本题考查氧化还原反应,为高频考点,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.某工业废水中,除H+、OH-外仅含下表离子中的几种.
甲同学欲探究废水的组成,进行了如下实验:
I.取少量废水样品,加入KSCN溶液无明显变化.
Ⅱ.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解.
请回答下列问题:
(1)废水中一定含有的金属阳离子是Al3+Cu2+(填离子符号).
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-.
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的CO32-(填离子符号),其判断理由是Al3+与CO32-在水溶液中同时发生水解且两个水解过程相互促进,故废水中不能大量存在CO32-(或Cu2+与CO32-结合生成CuCO3沉淀,故废水中不能大量存在CO32-).
| 阳离子 | Cu2+、Fe3+、Al3+、K+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42- |
I.取少量废水样品,加入KSCN溶液无明显变化.
Ⅱ.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解.
请回答下列问题:
(1)废水中一定含有的金属阳离子是Al3+Cu2+(填离子符号).
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-.
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的CO32-(填离子符号),其判断理由是Al3+与CO32-在水溶液中同时发生水解且两个水解过程相互促进,故废水中不能大量存在CO32-(或Cu2+与CO32-结合生成CuCO3沉淀,故废水中不能大量存在CO32-).
4.在无色透明溶液中,不能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
1.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| C. | 放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 该原电池,Zn作正极,可用石墨等作负极 |
18.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
5.苯与浓硫酸反应生成苯磺酸和水: +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )
 +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
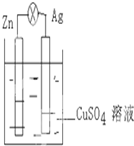 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液. 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
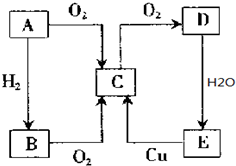 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.