题目内容
5.苯与浓硫酸反应生成苯磺酸和水: +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
分析 取代反应:有机物分子中某些原子或原子团被其它原子或原子团所替代的反应.
(1)是原子或原子团与另一原子或原子团的交换;
(2)两种物质反应,生成两种物质,有进有出.
解答 解:苯与浓硫酸反应生成苯磺酸和水,苯环上的氢原子被磺酸基取代生成苯磺酸,属于取代反应,故选:D.
点评 本题考查了取代反应的概念,难度不大,根据取代反应的概念判断即可.

练习册系列答案
相关题目
15.能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一.
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min时只改变了某一条件,10min时测得各物质浓度如表,则所改变的条件是向容器中充入1molH2;10min时v正>v逆(填“<”、“>”或“=”).
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
16.下列说法不正确的是( )
| A. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素中氢化物最稳定的其沸点一定最高 | |
| C. | 非金属元素形成的化合物中也可能是离子化合物 | |
| D. | 离子化合物中可能含有共价键 |
20.下列化合物沸点比较错误的是( )
| A. | 丙烷>乙烷>甲烷 | B. | 正戊烷>异戊烷>新戊烷 | ||
| C. | 丙三醇>乙二醇>乙醇 | D. | 对二甲苯>邻二甲苯>间二甲苯 |
10.为了鉴定氯乙烷中氯元素的存在,以下各步实验:①加入AgNO3溶液②加入NaOH的醇溶液,③加热 ④用HNO3酸化溶液 ⑤加入NaOH的水溶液其中操作顺序合理的是( )
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
17.对下列事实的解释正确的是( )
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于盐酸 | |
| C. | 向50 mL 18 mol•L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
14.四氯化碳是生产金属钛及其化合物的重要中间体,实验窒利用反应:TiO2(s)+2CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),制取TiCl4,实验装置如图所示: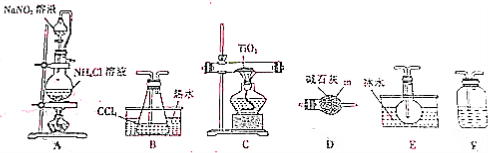
有关物质的性质如下表:
回答下列问题:
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中的液态混合物,所采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序是②③①(填序号)
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+2CO(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请简述对其他装置的改变:石英管内改为盛TiO2和C;增加CO的吸收装置;.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中的液态混合物,所采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序是②③①(填序号)
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+2CO(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请简述对其他装置的改变:石英管内改为盛TiO2和C;增加CO的吸收装置;.
15.下列各组物质不 属于同系物的是( )
| A. |  和 和 | B. | HOCH2-CH2OH和 | C. | CH3CH2OH和 | D. | HOCH2CH2OH和 |