题目内容
2.2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要.复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是D.
A.BaO2+2HCl冰═H2O2+BaCl2
B.Ag2O+H2O2═2Ag+O2+H2O
C.2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑
D.H2O2+NaCrO2+NaOH═Na2CrO4+H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂.已知:
N2H4(1)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1
H2O2(1)═H2O(1)+$\frac{1}{2}$O2(g)△H=-98.64kJ•mol-1
H2O(1)═H2O(g)△H=+44kJ•mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H=-643.28KJ/mol,
该反应的△S=>0(填“>”或“<”).
(3).将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)?xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,v(C)=0.1mol•L-1•min-1.
则:(1)x=2.
(2)前5min内B的反应速率v(B)=0.05mol/(L•min).
(3)平衡时A的转化率为50%.
分析 (1)过氧化氢做消毒剂是利用过氧化氢的氧化性,据此分析选项中元素化合价变化判断;
(2)依据热化学方程式和盖斯定律计算所需让化学方程式,分析计算得到热化学方程式分析熵变;
(3)先设A、B的物质的量为nmol;根据D的浓度计算D的物质的量,根据D的物质的量计算反应的A、B的物质的量,根据5min时,A、B浓度之比求出A、B开始时的物质的量,用开始时的物质的量减反应的物质的量即为5min末的物质的量,再根据物质的量浓度公式计算浓度;反应速率之比即为计量数之比;根据C的反应速率求A的反应速率.根据A的转化浓度计算A的转化率.
解答 解:(1)H2O2所体现的性质与其可以作为消毒剂完全一致的是,过氧化氢表现氧化性分析;
A.BaO2+2HCl$\frac{\underline{\;冰\;}}{\;}$H2O2+BaCl2,过氧化氢是反应生成物,故A错误;
B.Ag2O+H2O2═2Ag+O2+H2O,过氧化氢从-1价变化为0价,做还原剂,故B错误;
C.2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,过氧化氢自身氧化还原反应,故C错误;
D. H2O2+NaCrO2+NaOH═Na2CrO4+H2O,反应中过氧化氢氧元素化合价从-1价变化为-2价,反应中做氧化剂,故D正确;
故答案为:D;
(2)①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1
②H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H=-98.64kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-l
依据盖斯定律计算①+②×2+③×2得到,反应的热化学方程式:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-643.28KJ/mol;反应前后气体体积增大,所以△S>0;
故答案为:-643.28KJ/mol;>;
(3)D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始 n mol n mol 0 0
反应 1.5mol 0.5mol 1mol
5min (n-1.5)mol ( n-0.5)mol 1mol
同一容器中,c(A):c(B)=n(A):n(B)=$\frac{n-1.5}{n-0.5}$=$\frac{3}{5}$;n=3mol;
(1)D的浓度为0.5mol/L,反应时间为5min,D的反应速率为$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),C的反应速率是0.1mol/(L•min),根据同一反应中,各物质的反应速率之比等于计量数之比,所以x=2,故答案为:2;
(2)C的反应速率是0.1mol/(L•min),根据同一反应中,各物质的反应速率之比等于计量数之比,所以B的反应速率是0.5×0.1mol/(L•min)=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)A的转化率为:$\frac{1.5mol}{3mol}$×100%=50%,故答案为:50%.
点评 本题考查较综合,为高考常见题型,侧重考查学生的分析、计算能力,涉及氧化还原反应、化学反应速率与化学计量数的关系,根据反应物的物质的量关系运用三段式法计算平衡时的物质的量是解答该题的关键,注意同一反应中反应速率之比等于化学计量数之比.

| A. | 甲醛 | B. | MgSO4 | C. | NH4Cl | D. | Hg(NO3)2 |
①KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
②检验Mn2+的存在:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+
下列说法中错误的是( )
| A. | S2O82-离子中存在一个过氧键(-O-O-),则S2O82-离子中硫元素的化合价为+6 | |
| B. | 反应②若有0.1mol还原剂被氧化,则转移电子0.5mol | |
| C. | K2S2O8与浓盐酸混合可得到黄绿色气体 | |
| D. | 反应①配平后还原剂与还原产物之比为8:1 |
| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | H2SO4 |
| 选项 | 区分的物质 | 区分方法 |
| A | 蒸馏水和自来水 | ①蒸发 ②看颜色 |
| B | 食盐和面碱(Na2CO3) | ①加食醋 ②加石灰水 |
| C | 黄金和黄铜(假黄金) | ①灼烧 ②测密度 |
| D | 黑醋和酱油 | ①闻气味 ②尝味道 |
| A. | A | B. | B | C. | C | D. | D |
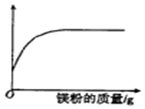
| A. | 溶液的质量 | B. | 稀盐酸的质量 | C. | 氯化镁的质量 | D. | 生成气体的质量 |
| A. | 测定0.1mol•L-1醋酸溶液的pH | |
| B. | 测定0.1 mol•L-1CH3COONa溶液的酸碱性 | |
| C. | 比较浓度均为0.1 mol•L-1盐酸和醋酸溶液的导电能力 | |
| D. | 比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积 |
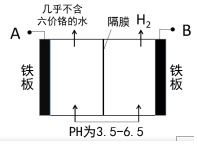 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )| A. | A接电源正极 | |
| B. | 阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 阴极区附近溶液pH减小 | |
| D. | 若不考虑气体的溶解,当收集到H2 13.44L时(标况),有0.1mol Cr2O72-被还原 |