题目内容
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
已知:N2(g)+O2(g)?2NO(g);△H=+180.5kJ/mo1
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 .
②汽车尾气中转化器中发生的反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H= .
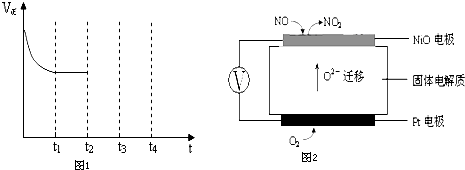
③在一定温度下,在密闭容器中充入NO和CO,t1时刻达到平衡状态.如图1,在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
④如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是 .
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(2)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H<0
在不同温度、不同投料比时,NO2的平衡转化率见表:
①写出该反应平衡常数的表达式K= .
②若温度不变,提高[
]投料比,则K将 .(填“增大”、“减小”或“不变”.)
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 .
(3)图2为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图.则NiO电极上NO发生的电极反应式为: .
(1)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
已知:N2(g)+O2(g)?2NO(g);△H=+180.5kJ/mo1
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是
②汽车尾气中转化器中发生的反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
③在一定温度下,在密闭容器中充入NO和CO,t1时刻达到平衡状态.如图1,在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

④如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(2)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g)+2NO2(g)
| 催化剂 |
在不同温度、不同投料比时,NO2的平衡转化率见表:
投料比[
| 400K | 500K | 600K | ||
| 1 | 60% | 43% | 28% | ||
| 2 | 45% | 33% | 20% |
②若温度不变,提高[
| n(NO2) |
| n(CH4) |
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数
(3)图2为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图.则NiO电极上NO发生的电极反应式为:
考点:热化学方程式,化学电源新型电池,化学平衡常数的含义,化学反应速率的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)①根据温度对化学平衡的影响进行判断;根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
②依据盖斯定律结合热化学方程式计算出该反应的焓变;
③增大容器体积,减小了压强,正逆反应速率减小,平衡向着气体体积增大的方向移动,据此画出从t2到t4时刻正反应速率随时间的变化曲线;
④根据影响化学反应速率、化学平衡的因素进行判断;
(2)①依据化学方程式结合平衡常数概念书写平衡常数表达式;
②平衡常数随温度变化,不随浓度变化;
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,二氧化氮转化率为60%,依据化学平衡三段式列式计算;
(3)根据图片知,铂电极上氧气得电子发生还原反应而作正极,NiO电极上NO失电子发生氧化反应,则NiO为负极,正极上电极反应式为:O2+4e-═2O2-,负极上电极反应式为:NO-2e-+O2-═NO2,结合电池内部离子移动方向判断.
②依据盖斯定律结合热化学方程式计算出该反应的焓变;
③增大容器体积,减小了压强,正逆反应速率减小,平衡向着气体体积增大的方向移动,据此画出从t2到t4时刻正反应速率随时间的变化曲线;
④根据影响化学反应速率、化学平衡的因素进行判断;
(2)①依据化学方程式结合平衡常数概念书写平衡常数表达式;
②平衡常数随温度变化,不随浓度变化;
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,二氧化氮转化率为60%,依据化学平衡三段式列式计算;
(3)根据图片知,铂电极上氧气得电子发生还原反应而作正极,NiO电极上NO失电子发生氧化反应,则NiO为负极,正极上电极反应式为:O2+4e-═2O2-,负极上电极反应式为:NO-2e-+O2-═NO2,结合电池内部离子移动方向判断.
解答:
解:(1)①由于升高温度,反应速率加快,平衡朝生成NO的方向移动,会导致单位时间内NO排放量越大;由于反应2CO(g)═2C(s)+O2(g)中△H>0,△S<0,在任何情况下都不能自发进行,
故答案为:升高温度,反应速率加快,平衡朝生成NO的方向移动;不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
②:a、N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1
b、2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
c、C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
根据盖斯定律可得:c×2-a-b,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
故答案为:-746.5 kJ?mol-1;
③在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是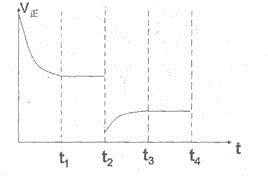 ,
,
故答案为: ;
;
④2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
A.降低温度,反应速率会减小,无法通过反应速率,故A错误;
B.增大压强同时加催化剂,增大压强后,平衡向着正向移动,一氧化氮的转化率增大,且反应速率增大,使用催化剂,反应速率加快,故B正确;
C.升高温度同时充入N2,升高温度平衡向着逆向移动,一氧化氮的转化率减小,故C错误;
D.及时将CO2和N2从反应体系中移走,一氧化氮的转化率增大,但是反应速率减小,故D错误
故答案为:B;
(2)①在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),反应的平衡常数表达式是利用平衡状态生成物浓度幂次方乘积除以反应物浓度幂次方乘积,该反应的平衡常数的表达式 K=
,
故答案为:
;
②平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变,故答案为:不变;
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,二氧化氮转化率为60%,充入一装有催化剂的容器中,充分反应后,则
CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)
n始 0.02 0.02 0 0 0
n转 0.006 0.02×0.6=0.012 0.006 0.006 0.012
n平 0.014 0.008 0.006 0.006 0.012
平衡时NO2的体积分数=
×100%=17.4%,
故答案为:17.4%;
(3)负极NiO上一氧化氮失电子和氧离子反应生成二氧化氮,电极反应式为NO-2e-+O2-═NO2,故答案为:NO-2e-+O2-═NO2;
故答案为:升高温度,反应速率加快,平衡朝生成NO的方向移动;不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
②:a、N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1
b、2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
c、C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
根据盖斯定律可得:c×2-a-b,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
故答案为:-746.5 kJ?mol-1;
③在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是
 ,
,故答案为:
 ;
;④2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
A.降低温度,反应速率会减小,无法通过反应速率,故A错误;
B.增大压强同时加催化剂,增大压强后,平衡向着正向移动,一氧化氮的转化率增大,且反应速率增大,使用催化剂,反应速率加快,故B正确;
C.升高温度同时充入N2,升高温度平衡向着逆向移动,一氧化氮的转化率减小,故C错误;
D.及时将CO2和N2从反应体系中移走,一氧化氮的转化率增大,但是反应速率减小,故D错误
故答案为:B;
(2)①在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),反应的平衡常数表达式是利用平衡状态生成物浓度幂次方乘积除以反应物浓度幂次方乘积,该反应的平衡常数的表达式 K=
| c(N2)c(CO2)c2(H2O) |
| c(CH4)c2(NO2) |
故答案为:
| c(N2)c(CO2)c2(H2O) |
| c(CH4)c2(NO2) |
②平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变,故答案为:不变;
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,二氧化氮转化率为60%,充入一装有催化剂的容器中,充分反应后,则
CH4(g)+2NO2(g)
| ||
| △ |
n始 0.02 0.02 0 0 0
n转 0.006 0.02×0.6=0.012 0.006 0.006 0.012
n平 0.014 0.008 0.006 0.006 0.012
平衡时NO2的体积分数=
| 0.008mol |
| 0.014mol+0.008mol+0.006mol+0.012mol |
故答案为:17.4%;
(3)负极NiO上一氧化氮失电子和氧离子反应生成二氧化氮,电极反应式为NO-2e-+O2-═NO2,故答案为:NO-2e-+O2-═NO2;
点评:本题考查了盖斯定律计算,原电池原理应用,化学平衡的建立过程、化学平衡的影响因素、有关化学平衡常数的计算等知识,题目难度较大,注意掌握化学平衡的影响因素,明确化学平衡常数的概念及计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
以下是几种常用基本物理量的名称与符号的对应关系,其中不正确的是( )
| A、物质的量mol |
| B、质量m |
| C、时间t |
| D、物质的量浓度C |
下列说法正确的是( )
| A、化合反应均为氧化还原反应,有单质生成的化学反应是氧化还原反应 |
| B、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C、溶液是电中性的,胶体是带电的 |
| D、电解质不一定导电,导电的物质不一定是电解质 |
 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊. 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.