题目内容
15.一定量的稀盐酸与过量铁粉反应时,为了减缓反应速率,且又不影响生成氢气的总量,可向稀盐酸中加入( )| A. | NaOH固体 | B. | CH3COONa固体 | C. | NaCl固体 | D. | CuCl2固体 |
分析 Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答.
解答 解:A.加NaOH固体,与盐酸反应,生成氢气减少,故A不选;
B.加CH3COONa(s),与盐酸反应生成醋酸,氢离子浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故B选;
C.加入氯化钠固体,不参与离子反应,反应速率没有影响,故C不选;
D.铁置换出铜,形成原电池反应,加快反应速率,故D不选.
故选B.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.下列物质不属于混合物的是( )
| A. | 铝热剂 | B. | 水玻璃 | C. | 胆矾 | D. | 漂白粉 |
6.下列解释过程或事实的方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
3.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
10.下列仪器中,不能用来振荡或摇匀液体的是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列说法正确的是( )
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | 淀粉和蛋白质水解的最终产物都能发生银镜反应 | |
| C. | 油脂都是高级脂肪酸甘油酯,在碱性条件下能发生皂化反应 | |
| D. | “乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物 |
7.35Cl和35Cl-两种微粒中,不同的是( )
| A. | 核内质子数 | B. | 核外电子层数 | C. | 核内中子数 | D. | 核外电子数 |
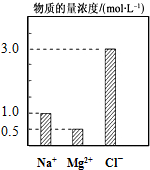 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题: