题目内容
10.下列仪器中,不能用来振荡或摇匀液体的是( )| A. |  | B. |  | C. |  | D. |  |
分析 振荡是表示一个过程,用于使反应物充分接触或溶解等,动作为水平方向上用手腕力量晃动容器.摇匀多表示要求达到一种均匀的状态,在定容时需上下颠倒容量瓶达到均匀,震荡是上下震荡,摇均是左右摇均.震荡时不一定要把容器倒过来.
解答 解:A.试管可用来震荡或摇匀液体,故A错误;
B.分液漏斗用来萃取时需要震荡,故B错误;
C.量筒是量取液体的仪器,不能用来震荡或摇匀液体,故C正确;
D.容量瓶定容后需要摇匀,故D错误.
故选C.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
20.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)氨基甲酸铵(NH2COONH4)分解反应是NH2COONH4(s)?2NH3(g)+CO2(g).
①某物质的标准摩尔生成焓是指在标准状态下由稳定单质生成1mol该物质时的反应焓变.
例如:CH3COOH的标准摩尔生成焓是指如下反应在标准状态下的焓变△H(CH3COOH)C(s)+O2(g)+H2(g)═CH3COOH(l)△H(CH3COOH)
已知NH2COONH4(s)、NH3(g)和CO2(g)的标准摩尔生成焓分别为△H1、△H2和△H3,则上述NH2COONH4分解反应的反应热△H=2△H2+△H3-△H1
②将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
实验测得不同温度下的平衡数据列于下表:
i.可以判断该分解反应已经达到化学平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
ii.根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.(保留两位有效数字)
iii.取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.下列说法正确的是c.
a、恒温、压缩容器体积,再次达到平衡后,容器内的压强大于原平衡压强
b、恒温、增大容器体积,再次达到平衡后,容器内的c(CO2)小于原平衡时的浓度
c、固定活塞、升高温度,再次达到平衡后,容器内的压强大于原平衡时的压强.
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
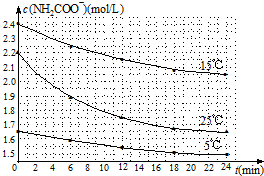
①计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
②根据图中信息,如何说明水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(1)氨基甲酸铵(NH2COONH4)分解反应是NH2COONH4(s)?2NH3(g)+CO2(g).
①某物质的标准摩尔生成焓是指在标准状态下由稳定单质生成1mol该物质时的反应焓变.
例如:CH3COOH的标准摩尔生成焓是指如下反应在标准状态下的焓变△H(CH3COOH)C(s)+O2(g)+H2(g)═CH3COOH(l)△H(CH3COOH)
已知NH2COONH4(s)、NH3(g)和CO2(g)的标准摩尔生成焓分别为△H1、△H2和△H3,则上述NH2COONH4分解反应的反应热△H=2△H2+△H3-△H1
②将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
ii.根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.(保留两位有效数字)
iii.取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.下列说法正确的是c.
a、恒温、压缩容器体积,再次达到平衡后,容器内的压强大于原平衡压强
b、恒温、增大容器体积,再次达到平衡后,容器内的c(CO2)小于原平衡时的浓度
c、固定活塞、升高温度,再次达到平衡后,容器内的压强大于原平衡时的压强.
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.

①计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
②根据图中信息,如何说明水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
1.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
18.在溶液中能大量共存,且加入稀硫酸时,有气体生成的是( )
| A. | Na+、Ag+、CO32-、Cl- | B. | K+、Ba2+、SO42-、Cl- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Na+、K+、Cl-、SO42- |
5.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | 结论:说明H2SO3酸性强于H2CO3 |
| B | SiO2是酸性氧化物 | SiO2不与任何酸溶液反应 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 浓硝酸具有强氧化性 | 应保存在棕色玻璃试剂瓶中 |
| A. | A | B. | B | C. | C | D. | D |
15.一定量的稀盐酸与过量铁粉反应时,为了减缓反应速率,且又不影响生成氢气的总量,可向稀盐酸中加入( )
| A. | NaOH固体 | B. | CH3COONa固体 | C. | NaCl固体 | D. | CuCl2固体 |
2.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<W | |
| C. | X的非金属性大于Y | |
| D. | W的最高价氧化物的水化物具有两性 |
19.如图是研究二氧化硫性质的微型实验装置(实验时用另一表面皿扣在上面),现用75%硫酸溶液和亚硫酸钠晶体反应制取SO2气体并进行实验,实验现象很明显.下列说法中错误的是( )


| A. | 品红溶液褪色 | B. | 紫色石蕊溶液先变红后褪色 | ||
| C. | 酸性KMnO4溶液紫色褪去 | D. | 含酚酞的NaOH溶液红色变浅 |
20.下列叙述正确的是( )
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| C. | 将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |